محلول سازی
محلول سازی یکی از ابتدایی ترین کارهای در ازمایشگاه است که لازمه هر کار ازمایشگاهی است به همین جهت در این جا روش های ساده ومختصری در مورد محلول سازی در ازمایشگاه برای شما جمع اوری کرده ام و امیدوارم که مورد استفاده قرار گیرد.
محلول سازی از محلول های غلیظ ازمایشگاه
معمولا در ازمایشگاه محلول ها به صورت غلیظ و با درصد خلوص مشخص و استانداردی وجود دارد و برای تهیه محلول های رقیق تر باید از ان ها استفاده کرد.
برای این کار از روابط رقیق سازی استفاده می کنیم :

در رابطه بالا نیاز است که نرمالیته یا مولاریته محلول غلیظ موجود در ازمایشگاه را تعیین کنیم. برای تعیین نرمالیته از فرمول زیر استفاده می کنیم :
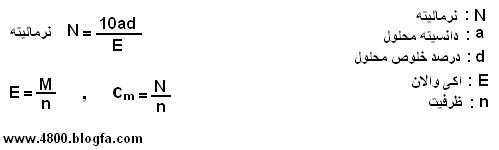
نرمالیته محلول غلیظ را بدست اوردیم. در رابطه اول فقط حجم محلول غلیظ ( v2 ) مجهول است که محاسبه می شود و فقط کافی است این مقدار (v1)را از محلول غلیظ برداشته و به حجم مورد نظر ( v2 ) برسانیم.
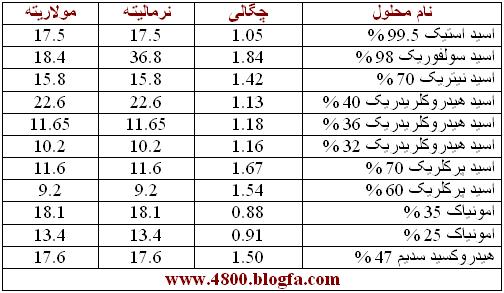
برای تعیین نرمالیته و مولاریته محلول های ازمایشگاهی می توانید از جدول زیر استفاده کنید. که در این صورت فقط به رابطه اول نیاز خواهید داشت.
مثال :
100cc محلول اسید سولفوریک 2N تهیه کنید ؟
اطلاعاتی نظیر دانسیته , درصد خلوص , جرم مولکولی و ... را می توانید از برچسب روی ظرف محلول بدست اورید.
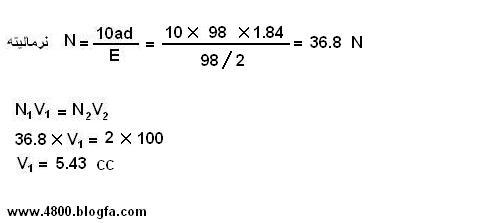
مقدار 5.43cc از محلول غلیظ اسید سولفوریک برداشته و به حجم 100cc برسانید. ( در بالون ژوژه 100cc )
تذکر : در مورد اسید های غلیظ و قوی مثل اسید سولفوریک همیشه اسید را به اب اضافه می کنیم. ( قبل از اضافه کردن اسید مقداری اب مقطر در بالون بریزید و سپس اسید را اضافه کنید. )
روش ساخت محلول با غلظت معین
بسیاری از واکنشهای شیمیایی تنها در محیط آبی قابل انجام هستند و برخی
دیگر در محیط آبی بهتر انجام میشوند و در نتیجه باید اجزای واکنش در آب یا
حلال دیگری حل شود. دلیل این امر جنبش مولکولهای مایعات و تراکم خوب آن
است که باعث میشود احتمال برخورد مولکولهای دخیل در واکنش زیاد شود
و واکنش بهتر و سریعتر انجام شود.
محلولسازی شامل حلشدن یک مادهی حلشونده (جامد، مایع، گاز) در یک مایع
حلال است.
حلال میتواند آب یا هر مایع دیگری باشد که قابلیت حلکردن حلشونده را داشته
باشد. برای انجام آزمایشهای علمی لازم است مقدار دقیق حلشونده در حلال
معلوم باشد. تیترسنجی، واکنشهای خنثیسازی و واکنشهای اکسیداسیون
و احیا از جمله مواردی هستند که با محلولسازی سروکار دارند.
 برای وزنکردن مواد جامد از یک ظرف تخت مثل پتری یا یک تکه کاغذ تمیز و صاف
برای وزنکردن مواد جامد از یک ظرف تخت مثل پتری یا یک تکه کاغذ تمیز و صافاستفاده کنید. آن را روی ترازو بگذارید و در صورت امکان سنجهی ترازو را صفر کنید.
اگر ترازو چنین امکانی ندارد، وزن آن را یادداشت کنید و از وزن کل کم کنید. پودر را
روی آن بریزید تا به وزن موردنظر شما برسد.
با توجه به وزن موردنیاز، ماده را با سرعت کم یا زیاد بریزید. سعی کنید بیشتر از مقدار
موردنیاز ماده را از ظرف آن خارج نکنید تا مجبور به بازگرداندن آن نباشید. به این روش
احتمال آلودهشدن و ناخالصی ماده را کاهش میدهید.
اگر از قاشق مخصوص (اسپاتول) استفاده میکنید، قاشقهای آغشته به مواد گوناگون
را برای یکدیگر استفاده نکنید.
 برای وزنکردن مایعات نیز میتوانید از بشر به روش قبل استفاده کنید.
برای وزنکردن مایعات نیز میتوانید از بشر به روش قبل استفاده کنید. برای ساختن محلول بهتر است از ظروف شیشهای مدرج با دهانهی باریک مثل بالن
برای ساختن محلول بهتر است از ظروف شیشهای مدرج با دهانهی باریک مثل بالن کفتخت یا ارلن استفاده کنید تا هنگام همزدن محلول با مشکل سرریزشدن مواجه نشوید.
 برای اندازهگیری حجم مایعات از ظروف شیشهای مدرج مانند استوانهی مدرج یا بشر
برای اندازهگیری حجم مایعات از ظروف شیشهای مدرج مانند استوانهی مدرج یا بشراستفاده کنید. هر چه درجهها ریزتر باشند، اندازهگیری شما دقیقتر خواهد بود.
 مایعاتی که بخار میشوند را زیر هود اندازهگیری کنید.
مایعاتی که بخار میشوند را زیر هود اندازهگیری کنید.روشهای محاسبهی غلظت محلول
درصد وزنی میزان گرم مادهی حلشونده در کل وزن محلول را گزارش میکند. این ویژگی
بیشتر روی محصولات تجاری درج میشود. مثل الکل صنعتی 96درصد که به معنای 96
گرم الکل به ازای 4 گرم آب مقطر در هر 100 گرم از محصول است. اما در محلولسازی
کاربردی در آزمایشگاهها بیشتر از روشهای زیر برای بیان غلظت محلول و محاسبهی آن
استفاده میشود.
درصد وزنی/ حجمی که به اختصار درصد وزنی نیز گفته میشود اولین روش بیان کمی
محلول با غلظت مشخص محلول درصد جرمی (وزنی) است. در این حالت جرم مشخصی
از حلشونده در حجم معینی از حلال، حل شود. به طوری که حجم کل حلشونده و حلال
(محلول) 100 سیسی گردد. (سیسی= میلیلیتر)
مثال: بیایید محاسبه کنیم برای ساختن 200 سیسی محلول 5 درصد کلریدسدیم چه
مقدار از مادهی حلشونده و حلال نیاز داریم.
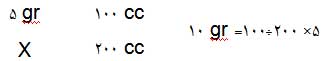
بنابراین برای ساختن چنین محلولی باید 10 گرم از نمک کلرید سدیم را در ظرف بریزیم
و روی آن آب اضافه کنیم تا حجم به 200 سیسی برسد.
اگرمحلول بسیار رقیق باشد یا به عبارتی وزن موردنیاز برای آمادهکردن محلول، غلظت بر
حسب قسمت در میلیون (ppm) بیان میشود. یعنی تعداد میلیگرم مادهی حلشونده
در یک لیتر محلول. برای مثال غلظت آنتیبیوتیکها به این گونه گزارش میشود.
زیرا مقدار موردنیاز آنها برای کارکرد کافی بسیار کم است.
محلول گرم در لیتر (غلظت=C) بیانکنندهی مقدار گرمی از مادهی حلشونده است که در
یک لیتر محلول حل شده باشد و به صورت گرم در لیتر بیان میشود.
مثال : وقتی 5 گرم گلوکز در 200 میلیلیتر از محلولی حل شده باشد، غلظت برابر 25 گرم/ لیتر
خواهد بود.
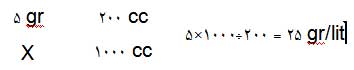
مولاریتهی یک محلول برابر است با تعداد مولهای ماده حل شده در هر لیتر آن محلول. این
روش بیان غلظت بیشترین کاربرد را در محلولسازی دارد.
یک مول برابر است با تعداد1023*022/6مولکول از ماده (عدد آووگادرو). برای این که تعداد مولکول
های ماده را در محلول اندازه بگیریم از مفهوم جرم مولی استفاده میکنیم. محلول 1 مول ماده
حلشونده در 1 لیتر محلول، محلولِ 1 مولار آن مادهی حلشونده نامیده میشود.
مولکولهای هر مادهای دارای جرم مخصوص به خود هستند. البته ممکن است جرم مولکولی
دو ماده شبیه هم باشد.
اما این عدد برای هر ماده ثابت است. بنابراین هر ماده با توجه به تعداد و نوع اتمهایی که در
هر مولکولش دارد، جرم مولی متفاوتی هم دارد. زیرا جرم مولی از ضرب عدد آووگادرو در جرم
مولکولی هر ماده به دست میآید. استفاده از واژهی «جرم مولکولی» به جای «جرم مولی»
رایج است.
با نگاهی به آن چه گفتیم درمییابید که با وزنکردن مادهی موردنظرتان و تقسیم آن بر جرم
مولی ماده میتوانید تعداد مولهای موجود در آن مقدار ماده را به دست بیاورید و برای
محلولسازی استفاده کنید.
مثال: محلول 1 مولار کلریدسدیم شامل 1 مول کلریدسدیم در یک لیتر محلول است. که با
توجه به وزن مولکولی (مولی) کلریدسدیم (=58/44 گرم) میفهمیم برای تهیهی 1000
سیسی محلول یک مولار آن باید به همین اندازه از پودر کلریدسدیم را با ترازو وزن کنیم
و روی آن آب بریزیم تا حجم آن به 1000 سیسی برسد.
در شکل زیر مشاهده میکنید که یک بشر کوچک روی ترازو گذاشته شده و داخل آن به
اندازهی 58/44 گرم پودر ریخته شده است. سپس پودر به درون یک بالن 1 لیتری منتقل
شده و به آن آب مقطر اضافه شده است تا به حجم برسد.

مثال: اگر بخواهیم 250 میلیلیتر محلولی از اسیدنیتریک بسازیم که غلظت آن 2 مولار باشد،
با توجه به جرم مولکولی اسیدنیتریک (= جرم یک مول از آن) که برابر با 63/01 گرم است به
روش زیر میتوانیم محاسبه کنیم.
در این روش ابتدا مقدار گرمی از اسیدنیتریک که برای تهیهی 1 لیتر (=1000 سیسی)
محلول 2 مولار لازم است را محاسبه میکنیم:
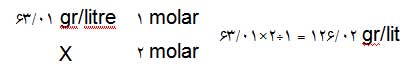
سپس باید مقدار گرم موردنیاز را برای 250 سیسی حساب کرد:
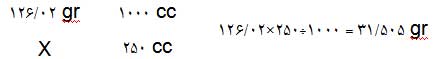
بنابراین برای آمادهکردن محلولی با مشخصات بالا باید مقدار 31/505 گرم از اسیدنیتریک
را وزن کنید و در یک ظرف مدرج (ارلن یا بالن) بریزید. بعد روی آن آبمقطر اضافه کنید تا
به علامت 250 سیسی برسد.
مولالیتهی یک محلول برابر است با تعداد مولهای ماده حل شده در 1 کیلوگرم حلال. این
واحد در محلولسازی کاربرد چندانی ندارد.
محلول نرمال محلولی است که یک اکیوالانگرم ماده حلشونده در 1 لیتر محلول، حل شده
باشد. مقدار وزن اکیوالان از رابطهی زیر به دست میآید:
E=M/n
که در آن M جرم مولکولی وn ظرفیت مادهی حلشونده میباشد. برای دریافت مفهوم اکی
والان و ظرفیت به مطلب مرتبط آن درسایت تبیان و دیگر منابع علمی مراجعه کنید.
برای ساخت محلولهای نرمال غالباً از بالنهای حجمی استفاده میشود. اگر چه مولاریته
و نرمالیتهی محلولها با تغییر دما اندکی تغییر میکنند اما همچنان مولاریته کاربردیترین
روش محاسبهی مقداری در محلولسازی میباشد. مولالیته یک محلول با تغییر دما ثابت
میماند. زیرا محلول بر مبنای جرم اجزای سازنده آن تهیه شده است و با تغییر دما وزن
تغییر نمیکند.◄ مولاريته:
مولاريته يا غلظت مولار که با (M) نشان داده ميشود، عبارت است از تعداد وزن مولکول گرم (يا تعداد مول) از يک جسم حل شده در يک ليتر محلول. مول کميت اساسي است که يک شيميدان تجزيه با آن سر و کار زيادي دارند. يک مول برابر با 6.023X1023 مولکول از يک جسم است. اصطلاح مول در يک مفهوم وسيع براي توصيف مقادير ترکيبات مولکولي ، عناصر آزاد و يونها بکار ميرود. به بيان ديگر وزن تعداد 6.023X1023 عدد مولکول ، يون يا عنصر برابر با 1 مول مولکول ، يون يا عنصر است که به صورت مولکول گرم ، يون گرم يا عنصر گرم ناميده ميشود.
◄ تهيه محلولهاي مولار:
براي تهيه يک محلول مولار از يک ترکيب بايد يک مول از آن را وزن کرده و به مقدار کافي به آن آب اضافه کنيم تا دقيقا يک ليتر محلول بدست ايد. به عنوان مثال براي تهيه يک محلول 2M از اسيد سولفوريک بايد گرم 196.16=98.08×2 از اسيد سولفوريک را در مقدار کافي آب حل کنيم تا يک ليتر محلول 2M اسيد سولفوريک بدست ايد. وقتي يک محلول مايع تهيه ميکنيم، حجم محلول به ندرت مساوي مجموع حجمهاي اجزا خالص سازنده آن است. معمولا حجم نهايي محلول بيشتر يا کمتر از مجموع حجمهاي اجزا سازنده آن است.
از اين رو براي تهيه يک محلول معين عملا نميتوانيم مقدار حلال لازم را پيشبيني کنيم. براي تهيه محلولهاي مولار و ساير محلولهايي که بر اساس حجم کل است، معمولا از بالنهاي حجمسنجي استفاده ميشود. در اين صورت براي تهيه يک محلول مقدار دقيق ماده حل شونده را در بالن جاي ميهيم و با دقت آن قدر آب ميافزائيم و بطور مداوم و با احتياط هم ميزنيم تا سطح محلول به خط نشانهاي که روي گردن بالن مشخص شده برسد.
◄ محاسبه غلظت يک محلول بر حسب مولاريته:
براي محاسبه غلظت يک محلول بر حسب مولاريته ابتدا بايد تعداد مولهاي جسم حل شده را بدست آوريم. تعداد مولهاي جسم حل شده از تقسيم کردن وزن آن (برحسب گرم) به وزن فرمولي بدست ميايد.
اگر ماده حل شده به صورت مولکولي باشد، در آن صورت تعداد مول از فرمول وزن مولکولي/گرمهاي ماده حل شده=تعداد مولها (مولکول حل شده) محاسبه ميشود.
اگر بخواهيم تعداد مولهاي يک يون را محاسبه کنيم، بايد بجاي وزن مولکولي وزن يون مربوطه را در فرمول قرار دهيم. يعني وزن يوني/گرمهاي ماده حل شده=تعداد مولها (يون حل شده).
اگر ماده حل شده به صورت اتمي باشد، مثلا نقره فلزي در آن صورت تعداد مولها از فرمول وزن اتمي/گرمهاي ماده حل شده = تعداد مولها (اتم حل شده) بدست ميايد. بعد از بدست آوردن تعداد مولهاي ماده حل شده با قرار دادن آن در فرمول غلظت مولار ، مولاريته محلول بدست ميايد. يعني داريم
ليتر محلول/ميلي مولهاي ماده حل شده= M
يا
ليتر محلول/تعداد مولهاي حل شده=M
وقتي غلظت محلول بر حسب مولاريته بيان ميشود، محاسبه مقدار ماده حل شده موجود در يک نمونه معين از محلول آسان است. به عنوان مثال يک ليتر محلول 2 مولار داراي 2 مول ماده حل شده است. 500ml آن داراي يک مول ماده حل شده ، 100ml آن داراي 0.2 مول ماده حل شده است.
◄ نکته مهم:
تنها اشکال تعيين غلظتها بر اساس حجم محلول اين است که چنين غلظتهايي با تغيير دما اندکي تغيير ميکنند، زيرا تغيير دما موجب انقباض يا انبساط محلول ميشود. بنابراين براي اينکه غلظت محلول تهيه شده دقيقتر باشد، بايد محلول در دمايي که قرار است استفاده شود، تهيه شده و از بالن حجم سنجي که در اين دما مدرج شده است استفاده شود. روش استاندارد کردن محلول 1/0 نرمال سدیم هیدروکسید :
معمولترین استاندارد اولیه ای که برای استاندارد کردن محلول سود در آزمایشگاه به کار می رود ، پتاسیم هیدروژن فتالات با درجه خلوص استاندارد اولیه است .
روش کار : مقداری پتاسیم هیدروژن فتالات (M = 204.23g/mol) را در اتوکلاو 110 درجه سانتیگراد به مدت یک ساعت خشک کرده و در دسیکاتور بگذارید تا سرد شود . البته پتاسیم هیدروژن فتالات ، زیاد رطوبت گیر نیست و می توانید این مرحله را با مشورت کارشناس حذف کنید . 7/0 تا 9/0 گرم پتاسیم هیدروژن فتالات خشک شده ( توجه : این مقدار استاندارد اولیه برای زمانی پیشنهاد شده است که از بورت 50 میلی لیتری استفاده شود ، زیرا حجم مصرفی تیتر کننده با این مقدار از استاندارد اولیه در حدود 35 تا 45 میلی لیتر است . بنابراین اگر می خواهید از بورت 25 میلی لیتری استفاده کنید ؛ وزن استاندارد اولیه را نصف کنید . ) را در یک ظرف توزین ، تمیز و خشک وزن کنید و با 50 میلی لیتر آب مقطر به ارلن مایر 250 میلی لیتری منتقل کنید . 2 قطره شناساگر فنول فتالئین ، به محلول اضافه کنید و آن را با سودی که ساخته اید تیتر کنید ( همه اصول یک تیتراسیون کلاسیک را رعایت کنید . این اصول عبارتنداز : شستشوی بورت با محلول تیتر کننده ، خشک کردن بدنه ارلن و سکوی آزمایشگاه و گذاشتن یک ورق کاغذ سفید در زیر ارلن به هنگام تیتراسیون . ) . نقطه پایانی زمانی است که رنگ صورتی محلول 30 ثانیه پایدار باشد . حال غلظت سود را از رابطه زیر بدست آورید :
روش استاندارد کردن محلول 1/0 نرمال کلریدریک اسید :
استاندارد اولیه ای که بیشتر برای استاندارد کردن کلریدریک اسید به کار می رود ، سدیم کربنات با درجه خلوص استاندارد اولیه است . سدیم کربنات طبق معادله زیر با کلریدریک اسید واکنش می دهد :
روش کار : مقداری سدیم کربنات جامد را در اتوکلاو 110 درجه سانتیگراد به مدت یک ساعت خشک کنید و در دسیکاتور بگذارید تا سرد شود . 2/0 تا 25/0 گرم از آن را در یک ظرف توزین تمیز و خشک وزن کنید و وزن دقیق آن را در دفترچه یادداشت خود بنویسید . نمونه را با 50 میلی لیتر آب مقطر به ارلن مایر تیتراسیون منتقل کنید و 2 الی 3 قطره شناساگر سبز برموکرزول به آن اضافه کنید . حال محلول را با کلریدریک اسیدی که ساخته اید تیتر کنید . نقطه پایانی زمانی است که رنگ محلول از آبی ، به سبز مایل به زرد تبدیل شود . حال غلظت کلریدریک اسید را از رابطه زیر بدست آورید :
روش استاندارد کردن محلول 1/0 مولار نقره نیترات ( روش مور ) :
مقداری NaCl یا KCl جامد و خالص را در اتوکلاو 120 درجه سانتیگراد به مدت دو ساعت خشک کنید . سپس 2/0 تا 25/0 گرم NaCl یا 25/0 تا 3/0 گرم KCl را با یک ترازوی تجزیه ای وزن کنید و وزن دقیق آن را در دفترچه یادداشت بنویسید . نمک را با 75 میلی لیتر آب مقطر به ارلن مایر تیتراسیون منتقل و 2 میلی لیتر محلول پتاسیم کرومات 1/0 مولار ( 96/1 گرم پتاسیم کرومات در 100 میلی لیتر آب ) به آن اضافه کنید . حال محلول را بوسیله نقره نیتراتی که تهیه کرده اید تیتر کنید . تشخیص نقطه پایانی در این تیتراسیون کمی مشکل است و نیاز به مهارت دارد . اما اگر تیتراسیون را سه بار تکرار کنید ، به راحتی می توانید نقطه پایانی را تشخیص دهید .
برای کمک به تشخیص نقطه پایانی به موضوع زیر توجه کنید :
محلول داخل ارلن تا قبل از شروع تیتراسیون به خاطر حضور یون کرومات ( شناساگر ) زرد شفاف است . با شروع تیتراسیون و تشکیل رسوب شیری رنگ AgCl محلول کم کم به رنگ زرد لیمویی مات ( کدر ) تبدیل می شود . نقطه پایانی زمانی است که تمام یون کلر در محلول رسوب کرده و با افزودن نقره نیترات بیشتر ، کرومات وارد واکنش شده و رسوب قرمز آجری Ag2CrO4 بوجود می آید . اما طبق معمول چون شروع تشکیل این رسوب نقطه پایانی ، محسوب می شود ، باید به محض تغییر رنگ محلول از زرد لیمویی ، به زرد لیمویی چرک آب یا کثیف ( مخلوطی از زرد لیمویی با رگه ای از قرمز آجری که تمام ارلن را فراگیرد ) تیتراسیون را قطع کرد .
حال غلظت نیترات نقره را از رابطه زیر بدست آورید :
.
روش استاندارد کردن محلول 1/0 نرمال پتاسیم پرمنگنات :
یکی از استانداردهای اولیه ای که برای استاندارد کردن پتاسیم پرمنگنات به کار می رود ، سدیم اگزالات یا اگزالیک اسید است .
مقداری سدیم اگزالات با درجه خلوص استاندارد اولیه را در اتوکلاو 110 درجه سانتیگراد به مدت 1 تا 2 ساعت خشک و در دسیکاتور بگذارید تا سرد شود . 25/0 تا 3/0 گرم از سدیم اگزالات خشک (M=134.00g/mol) را در یک ظرف توزین تمیز و خشک وزن کنید . و با 50 تا 75 میلی لیتر آب مقطر به ارلن مایر تیتراسیون منتقل کنید . 3 تا 5/3 میلی لیتر سولفوریک اسید غلیظ به محلول اضافه کنید و آن را کاملاً گرم کنید ( محلول به جوش نیاید ) . حال بلافاصله محلول را با پرمنگناتی که ساخته و صاف کرده اید ، تیتر کنید . به خاطر داشته باشید که دمای محلول در تمام مدت تیتراسیون از 55 درجه سانتیگراد نباید پایینتر بیاید . نقطه پایانی زمانی است که محلول با یک قطره از پرمنگنات تغییر رنگ دهد . ( مانند یک قطره پرمنگنات در آب ) و این تغییر رنگ به مدت 30 ثانیه پایدار باشد .
حال غلظت پرمنگنات پتاسیم را از رابطه زیر بدست آورید :
روش استاندارد کردن محلول 1/0 مولار سدیم – EDTA :
محلول های EDTA را معمولاً با یکی از نمکهای منیزیم (MgSO4 or MgCl2) استاندارد می کنند . برای مثال در حدود 7/0 تا 9/0 گرم MgCl2.6H2O را با ترازوی تجزیه ای وزن کنید . و وزن دقیق آن را در دفترچه یادداشت خود بنویسید . نمونه را با 50 تا 75 میلی لیتر آب مقطر و 5 میلی لیتر محلول بافر آمونیاک – آمونیوم کلرید و دو قطره شناساگر اریوکروم بلک T به محلول اضافه کنید . محلول را با EDTA ساخته شده تیتر کنید . نقطه پایانی زمانی است که محلول با یک قطره از EDTA از قرمز اناری به آبی آسمانی تغییر رنگ دهد .
حال غلظت سدیم – EDTA را از رابطه زیر بدست آورید :
روش تهیه شناساگرها و محلولهای مورد نیاز :
روش تهیه شناساگر فنول فتالئین :
1/0 گرم فنول فتالئین جامد را در 80 میلی لیتر الکل اتیلیک حل کنید و حجم آن را با آب مقطر به 100 میلی لیتر برسانید .
روش تهیه شناساگر سبز برموکرزول :
1/0 گرم از سبز برموکرزول جامد را در چند قطره سود 1/0 نرمال حل کنید و حجم آن را با آب مقطر به 100 میلی لیتر برسانید .
روش تهیه محلول بافر 10 :
75/6 گرم آمونیوم کلرید را در 57 میلی لیتر آمونیاک غلیظ حل کنید و حجم آن را با آب مقطر به 100 میلی لیتر برسانید ، pH این محلول کمی بیشتر از 10 است .
روش تهیه شناساگر اریوکروم بلک T :
اریوکروم بلک T را می توان به دو صورت تهیه کرد :
الف ) به صورت محلول : 5/0 گرم اریوکروم بلک T را در 100 میلی لیتر الکل اتیلیک حل کنید . و روی آن تاریخ بزنید . این شناساگر را اگر در یخچال نگهداری کنید ، 6 هفته تا دو ماه قابل استفاده است .
ب ) به صورت جامد : 100 گرم اریوکروم بلک T را با 10 گرم NaCl و 10 گرم هیدروکسیل آمین هیدروکلرید آسیاب کنید و مقدار کمی از آن را با سر اسپاتول به محلول تیتراسیون اضافه کنید . این شناساگر به صورت جامد طول عمر بسیار طولانی تری دارد .

 دانلود مقاله ارزیابی سنتیکی تبدیل متانول به الفین های سبک روی کاتالیست SAPO-34
دانلود مقاله ارزیابی سنتیکی تبدیل متانول به الفین های سبک روی کاتالیست SAPO-34
 دانلود شرح فرآیند واحد FCC پالایشگاه آبادان
دانلود شرح فرآیند واحد FCC پالایشگاه آبادان
 دانلود پروژه کلر زنی
دانلود پروژه کلر زنی
 گزارش کارآموزی شرکت گاز در واحد تعمیرات اساسی
گزارش کارآموزی شرکت گاز در واحد تعمیرات اساسی
 تولید اب نوشیدنی خنک دربیابان!!!
تولید اب نوشیدنی خنک دربیابان!!! نرم افزار متخصصین علوم شیمی محاسباتی Gaussian 09W v7.0 + GaussView v5.08 + Nanotube Modeler v1.6.4
نرم افزار متخصصین علوم شیمی محاسباتی Gaussian 09W v7.0 + GaussView v5.08 + Nanotube Modeler v1.6.4 در مورد بوگاتی چه میدانید؟!قسمت اول
در مورد بوگاتی چه میدانید؟!قسمت اول