حذف فلزات سنگین از فاضلاب هاي صنعتی در ادامه مطلب
تعادل 4
جهت مشاهده مطلب قبلی تعادل اینجا کلیک کنید.

کنترل یک واکنش:
در مطالب قبل به ویژگی های سیستمهای در حال تعادل اشاره کردیم و با ثابت تعادل آشنا شدیم...
حال میخواهیم بدانیم آیا میتوانیم واکنش را به دلخواه خودمان کنترل کنیم؟
جواب مثبت است!
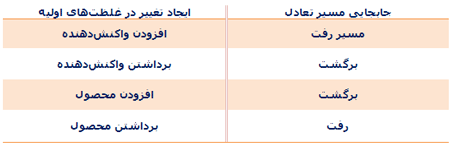
برای اینکه محصول بیشتری تولید کنیم و یا بازده واکنش را بالا ببریم، میتوانیم تغییرات زیر را در سیستم واکنش ایجاد کنیم:

- تغییر غلظتهای واکنش دهندهها یا محصولات
- تغییر دما
- تغییر فشار و حجم (برای یک واکنش در فاز گازی)
در واکنشهای تعادلی، هر تغییری در سیستم صورت گیرد، سیستم سعی خواهد کرد به سمتی پیش رود که باز هم حالت تعادل را برقرار کند. تغییرات ذکر شده در بالا نیز حالت تعادلی سیستم را به طور موقت بر هم می زنند.
اصل لوشاتلیه:
حالت تعادل در هر سیستمی به عوامل موجود در سیستم مانند دما، فشار و غلظت اجزای مختلف بستگی دارد. این عوامل، پارامتر یا متغیرهای واکنش نامیده میشوند.
یک تغییر در هر کدام از پارامترهای واکنش، ممکن است وضعیت تعادلی سیستم را تحت تأثیر قرار دهد.
قاعدهی کلی که میتواند تأثیر تغییرات این پارامترها را بر روی حالت تعادل توصیف کند، توسط اچ. لوشاتلیه (1885) و اف. بارون (1886) فرمولبندی شده ولی به طور مشترک، اصل لوشاتلیه نامیده میشود.
این اصل، کاربرد سودمند بزرگی برای تمام سیستمهای فیزیکی و شیمیایی دارد.
این اصل بیان میکند هر سیستمی که در معرض تغییری در پارامترهای خود قرار میگیرد، فرایندهایی در سیستم اتفاق میافتد که با تغییر اولیه مخالفت کنند؛ بنابراین سیستم به یک وضعیت تعادلی جدید میرسد.
تغییر غلظت واکنشدهندهها یا محصولات:
یک سیستم شیمیایی در حال تعادل در نظر بگیرید. اگر تعادل با تغییر غلظت هر کدام از اجزای واکنش به هم بخورد، تعادل به جهتی انتقال پیدا خواهد کرد که سعی در برگرداندن سیستم به وضعیت اصلیاش خواهد کرد. به مثال زیر توجه کنید:
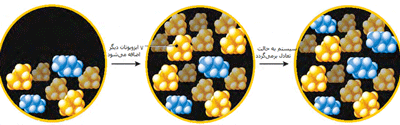
سیستمی از مخلوط 5 مولکول ایزوبوتان و 2 مولکول بوتان در حال تعادل است. با اضافه کردن هفت ایزوبوتان دیگر، سیستم از حالت تعادل خارج میشود.
شبکهای از دو مولکول ایزوبوتان به مولکول بوتان تغییر میکند تا بازهم مخلوطی به دست آید که حالت تعادلی برقرار شود. نسبت ایزوبوتان به بوتان، 5 به 2 است.
در واکنش زیر، افزودن BaCl2 باعث جابجاشدن مسیر تعادل در مسیر رفت خواهد شد تا وضعیت تعادلی جدید برقرار شود:
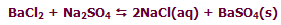
در واکنش زیر افزودن Cl2 به حالت تعادل سیستم، باعث جابجا شدن مسیر تعادلی سیستم در جهت برگشت خواهد شد:
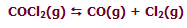
به نظر شما با این افزایش Cl2 چه اتفاقی برای غلظت CO خواهد افتاد؟
اثر حجم:
اگر یک سیستم گازی متراکم شود، فشار افزایش پیدا میکند و باعث میشود سیستم با یک شیفت (جابجایی) در جهت مولکولهای گازی کمتر تا اندازهای از فشار و تغییر ایجاد شده رهایی پیدا کند.
در حالتی که سیستم منبسط شود، فشار کاهش پیدا میکند و یک شیفت در جهت مولکولهای گازی بیشتر تا اندازهای به حالت تعادلی اولیه باز میگردد.
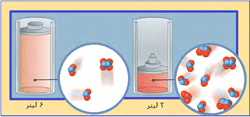
در شکل بالا، گاز N2O4 با NO2 در حال تعادل است:
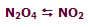
ابتدا نسبت N2O4 به NO2، مقدار 1 به 2 است (1:2) . سپس حجم سیستم به یک سوم حجم اولیه کاهش مییابد (سیستم متراکم میشود) و برای اینکه سیستم به تعادل دوباره برسد، واکنش به سمتی جابجا میشود که این فشار افزایش یافته را کم کند (جهتی که تعداد مولکولها را کاهش دهد)؛ بنابراین تعادل دوباره برقرار میشود (نسبت N2O4 به NO2 اکنون 4:5 است).
جابجایی مسیر تعادل با تغییر دمای سیستم:
با یک مثال این بحث را شروع میکنیم؛ زمانی که یک مول گاز استیلن با دو مول گاز هیدروژن واکنش نشان دهد، یک مول گاز اتان تشکیل میشود و 311 کیلوژول انرژی آزاد میکند؛ بنابراین یک واکنش گرماده است.
|
گرما، محصول دیگر این واکنش است: |
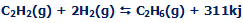 |
ΔH=-311KJ به معنای آزاد شدن 311 کیلوژول انرژی گرمایی از این واکنش است.
- در واکنشهای گرماده که با فرمول کلی:
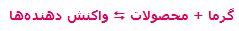
مشخص میشوند، افزودن گرما و حرارت دادن به سیستم باعث جابجایی مسیر تعادل در جهت برگشت میشود (یعنی واکنش دهندهی بیشتر). به همین ترتیب، برداشتن حرارت و گرما از سیستم باعث جابجایی تعادل در مسیر رفت میشود (تا محصول بیشتری تولید کند).
به مثال زیر توجه کنید:
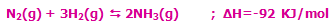
با کاهش دمای سیستم در این واکنش گرماده (برداشتن حرارت از سیستم)، مسیر رفت واکنش تعادلی، پیشرفت میکند تا محصول بیشتری تولید شود!
- در واکنشهای گرماگیر که با فرمول کلی:

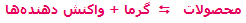
مشخص می شوند، افزودن حرارت به سیستم باعث جابجایی و شیفت تعادل به سمت رفت واکنش می شود (محصول بیش تری تولید می شود) و برداشتن حرارت و کم شدن دمای سیستم باعث شیفت تعادل به سمت برگشت می شود (واکنش دهنده ی بیش تر). به مثال زیر توجه کنید:
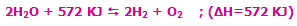
با افزایش دمای سیستم در این واکنش گرماگیر، واکنش در جهت رفت پیش میرود تا اکسیژن و هیدروژن بیشتری تولید کند.
تعادل 3
برای مشاهده مطلب قبلی تعادل اینجا کلیک کنید

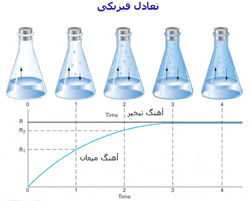
تغییرات آهنگ واکنش در هنگام نزدیک شدن واکنش به حالت تعادل:
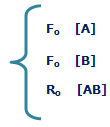
به شکل زیر توجه کنید؛ در لحظهی t=0 مقدار زیادی از مولکولهای A و B وجود دارد (در t=0 محصول AB تشکیل نشده است) و واکنش رفت سریع است (آهنگ واکنش رفت با Fo نشان داده میشود) و واکنش برگشت اتفاق نیفتاده است (آهنگ واکنش برگشت با Ro نشان داده میشود).
با گذشت زمان، AB تشکیل میشود و A و B مصرف میشوند، بنابراین طبیعی است که آهنگ رفت و برگشت تغییر کند. هر چه زمان میگذرد، واکنش رفت کندتر شده (A و B کمتری باقی مانده) و واکنش برگشت سرعت میگیرد (مولکولهای AB بیشتری تولید شده است).
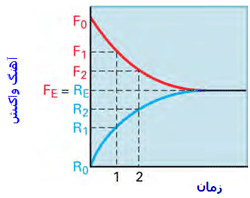
آهنگ واکنش:
در حالت تعادل، آهنگ واکنش رفت و برگشت دقیقاً با هم مساوی خواهند بود:
 |
 |
 |
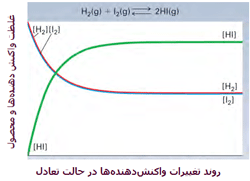
به عنوان یک مثال از بحث قبلی، واکنش گاز هیدروژن با گاز ید را در نظر میگیریم:
این دو گاز برای تشکیل یدید هیدروژن (HI) با هم وارد واکنش میشوند. هنگامی که سیستم به تعادل میرسد، آهنگ واکنش رفت و برگشت کاملاً با هم برابر میشوند و غلظت نسبی HI، H2 و I2 ثابت باقی میماند. در حالت تعادل، مقدار HI از H2 و I2 بیشتر است. در شکل زیر، روند این واکنش را مشاهده میکنید.
منظور از [HI] غلظت مولکولهای HI در واکنش است.
ثابت تعادل:
در واکنش ید و هیدروژن و تشکیل یدید هیدروژن، مقادیر نسبی HI، I2 و H2 در سیستمهای تعادلی مختلف با ثابت تعادل واکنش تعریف میشود. این مقادیر در جدول زیر آمدهاند.
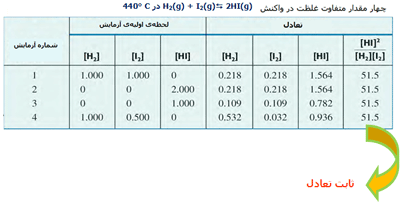
حال ببینیم چگونه میتوان ثابت تعادل را محاسبه کرد؟
برای هر واکنش شیمیایی در یک دمای معین، نسبت حاصلضرب غلظت اجزای سمت راست واکنش که هر کدام از آنها به توان ضریب خود (تعداد آن محصول) میرسد، به حاصلضرب غلظت اجزای سمت راست واکنش که آنها نیز به توان ضریب خود میرسند، مقدار ثابتی دارد که به آن ثابت تعادل (K) گفته میشود.
در واکنش زیر، محاسبهی ثابت تعادل با استفاده از روش ذکر شده بدین صورت خواهد بود:
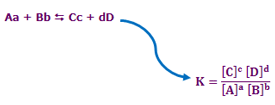
K ثابت تعادل واکنش بوده و مستقل از دما و نوع واکنش است.
به عنوان مثال محاسبهی ثابت تعادل واکنش، معادلهی زیر را در نظر میگیریم:
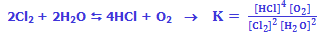
مواد واکنش دهندهی جامد و مایع در اکثر واکنشهای شیمیایی، غلظتهای ثابتی دارند و در محاسبهی K از آنها صرفنظر میشود:
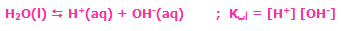
مقدار ثابت تعادل اطلاعات جالبی راجع به غلظت مواد درگیر واکنش و مورد توجه بودن واکنش رفت یا برگشت به ما می دهد؛ به عنوان مثال وقتی می گوییم مقدار K یک واکنش 1 * 109 است، یعنی غلظت محصولات به طور چشم گیری بیش تر از غلظت واکنشدهنده هاست ( 109 * 1 برابر غلظت واکنش دهنده ها است). برای نمکهایی که به سختی در آب حل می شوند، KSP تعریف می شود که ثابت حاصلضرب انحلال پذیری نام دارد.
مقدار K هر چه که باشد، میتوان آنرا اینگونه تفسیر کرد:

وقتی [ محصولات ] > [ واکنشدهندهها ] و K بزرگ است:
- واکنش، تشکیل محصولات را آسان میکند.
- واکنش در جهت رفت پیشرفت کرده است.

وقتی [ واکنشدهندهها ] > [ محصولات ] و K کوچک است:
- واکنش، تشکیل محصولات را آسان میکند.
- واکنش در جهت برگشت پیشرفت کرده است.

وقتی K از 0.1 تا 10 تغییر میکند و [ محصولات ] تقریبا مساوی با [ واکنشدهندهها ]:
- مقادیر قابل توجه و محسوسی از هر دو موجود است.
در تمام موارد بالا، سیستم در حالت تعادل قرار دارد.
تعادل 2:
جهت دیدن مطلب قبلی درباره تعادل اینجا کلیک کنید.
در مطلب قبل به شرایط تعادل و انجام واکنشهای شیمیایی اشاره شد. حال ببینیم فراهم شدن شرایط واکنش، گویای کدام خاصیت فیزیکی مواد است و چه عواملی، انجام سریعتر و بهینهتر واکنشهای مواد را تحت تأثیر قرار میدهند؟
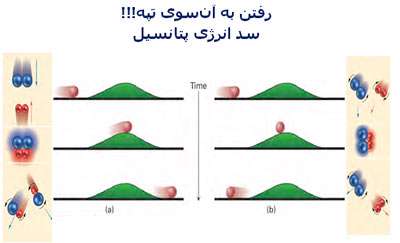
در شکل بالا به خوبی دیده میشود که برای این که واکنشی صورت پذیرد، شرایط لازم برای آن (تعداد و جهت مناسب ذرات واکنش دهنده و انرژی جنبشی کافی آن ها) چگونه تشکیل محصولات را تحت تأثیر قرار می دهد.
در حالت (a) سیستم، انرژی کافی برای رفتن به آن سوی تپه و غلبه به سد انرژی پتانسیل را دارد؛ بنابراین محصولات تشکیل میشوند.
در حالت (b) سیستم، انرژی کافی برای عبور از سد انرژی پتانسیل ندارد؛ بنابراین محصولات این برخورد ناموفق تشکیل نمیشوند.
در مطلب قبلی گفته شد که انرژی فعالسازی، حداقل انرژی لازم برای ایجاد انرژی برخورد مؤثر است تا واکنش انجام شود. با مقایسهی این مطلب و شکل قبل میبینیم که اگر شرایط انجام واکنش مهیا باشد و انرژی فعالسازی نیز کافی باشد، میتوان به سد پتانسیل غلبه کرد. به نظر شما این سد پتانسیل ناشی از چیست؟
حال ببینیم چه عواملی بر سرعت و کارایی واکنش های شیمیایی تأثیر دارند:
· دمای واکنش: با افزایش دما سرعت انجام واکنش نیز بالا می رود.
· کاتالیزگرها: کاتالیست مناسب، سرعت واکنش را بالا می برد.
· غلظت واکنش دهنده ها: غلظت زیاد واکنش دهنده ها موجب سرعت یافتن واکنش می شود.
اثر دما بر آهنگ واکنش:
در فرایند تبخیر مولکول های آب در یک ظرف در بستهی نیمه پر، مولکول ها در فضای گازی بالای آب در حال تبخیر، توزیعی از سرعت های مختلف دارند؛ برخی از این مولکول ها کند و برخی بسیار سریع حرکت می کنند.
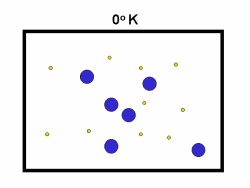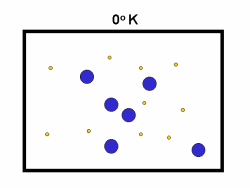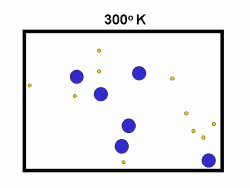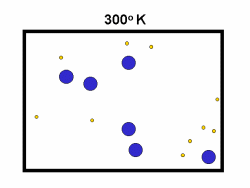
شکل بالا این مطلب را به خوبی نشان میدهد؛ دایرههای آبی، مولکولهاییاند که سرعت حرکت بالایی دارند و دایرههای قرمز، مولکول هاییاند که سرعت کمی دارند. حال ببینیم تغییر دما چه تأثیری بر روی سرعت مولکول ها دارد؟
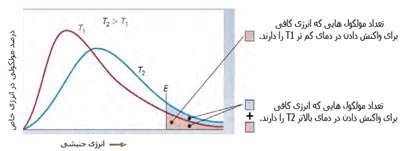
· تنها کسری از مولکولهای نشان داده شده در ناحیهی پایینی منحنی در سمت راست، انرژی جنبشی کافی برای واکنش دادن دارند.
· کسر بزرگی از مولکولها میتوانند در دماهای بالاتر واکنش دهند.
در زندگی روزمره نیز واکنشهای شیمیایی فراوانی را در همین ارتباط مشاهده میکنیم؛ به عنوان مثال، آهنگ فاسد شدن غذای منجمد شده نسبت به غذایی که در دمای عادی نگهداری میشود، کمتر است. همچنین، غذا در زودپز خیلی سریعتر از حالت عادی پختن غذا میپزد زیرا در دمای بالاتری به جوش میآید اما همین غذا اگر در منطقهای که ارتفاع بالایی نسبت به سطح دریا دارد پخته شود، دیر خواهد پخت؛ زیرا فشار پایینتر، نقطهی جوش را پایینتر میآورد.
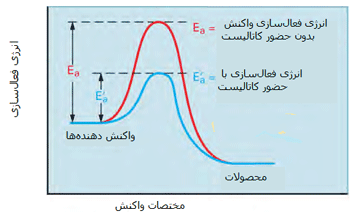
نقش کاتالیزورها در آهنگ واکنش:
مطابق شکل زیر، یک کاتالیست راهی را فراهم میکند که واکنش با انرژی فعالسازی کمتری اتفاق بیفتد؛ بنابراین بیشتر مولکولهایی که انرژی جنبشی کمتری دارند، قادر خواهند بود از سد انرژی پتانسیل عبور کنند.
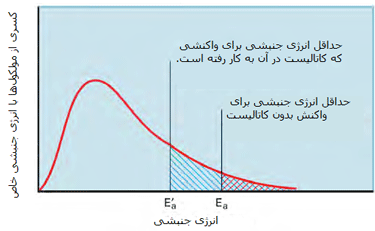
در شکل دوم، کسری از مولکولها با انرژی کافی برای وارد شدن به برخوردهایی که باعث انجام واکنش میشوند، در صورت وجود کاتالیست افزایش پیدا میکند زیرا سد انرژی فعالسازی پایین میآید.
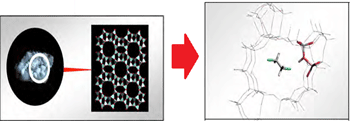
حال مثالی از نقش کاتالیست زئولیت (نوعی سیلیکات آبدار) در انجام واکنش میآوریم تا این مطلب را به خوبی درک کنید:
زئولیتها جامدهایی با شبکهی کوالانسیاند و دارای حفرهها و کانالهایی خاص هستند و مولکولهای گازی میتوانند از طریق این کانالها پخش شوند. زمانی که دو مولکول گاز درون زئولیت با همدیگر روبهرو میشوند، مجبور به نزدیک شدن به هم در یک جهت ویژه میشوند (این جهت ویژه، جهتگیری درست برای انجام واکنش است). این دو مولکول مدت طولانی را با هم میمانند و شانس بیشتری برای واکنش دارند. طبیعت کاتالیستها این است که به طور مستقیم در واکنش شرکت میکنند (اما واکنشدهنده یا محصول نیستند) و محیط مناسبی برای انجام واکنش فراهم کرده و سد انرژی فعالسازی را پایین میآورند.
 |
تأثیر غلظت بر سرعت واکنش:
آهنگ یک واکنش به تعداد برخوردها در واحد زمان نیز بستگی دارد. هرچه تعداد ذرات موجود در حجم خاص که واکنش در آن صورت میگیرد زیاد باشد، برخوردهای متوالی بیشتری اتفاق خواهد افتاد و واکنشها با سرعت بیشتری انجام خواهند گرفت. به شکل زیر که سوختن برادهی فولاد در اکسیژن را نشان میدهد، توجه کنید:

در ردیف اول، برادهی فولاد در هوا (غلظت کم اکسیژن) حرارت داده میشود. در ردیف دوم، برادهی فولاد در اکسیژن خاص حرارت داده میشود. این مشاهده براساس توجیهات بالا کاملاً قابل درک است.
تعادل 1

· تعادل چیست؟
· چگونه به سرعت میتوان به تعادل در یک واکنش شیمیایی رسید؟
· آیا دما روی تعادل و آهنگ واکنش تأثیر دارد؟
· ثابت تعادل چیست؟
· آیا تعادل روی مقدار محصولات واکنش (بازده) تأثیر دارد؟
در این مجموعه به تمامی سؤالات بالا پاسخ خواهیم داد. اما به راستی تعادل چیست؟ تعادل شیمیایی و تعادل فیزیکی چگونه حاصل میشوند؟
زمانی که یک واکنش شیمیایی شروع میشود، ابتدا واکنش دهندهها وارد عمل میشوند. رفته رفته از غلظت واکنش دهندهها کم شده و به غلظت محصولات اضافه میشود. در نهایت، زمانی میرسد که هیچ تغییری در غلظت واکنش دهندهها و محصولات مشاهده نمیشود. چنین واکنشهایی که در آنها فقط قسمتی از مقدار کلی واکنش دهندهها به محصول تبدیل میشود، فرایندهای برگشتپذیر نامیده میشوند.
تعادل زمانی است که:
- هر تغییری در طول واکنش برگشتپذیر است و میتواند با معادلهای که شامل یک فلش دوطرفه است، نشان داده شود.
- سیستم تعادلی، محصور و بسته است؛ سیستم بسته و محصور به سیستمی گفته میشود که هیچ مادهای نتواند وارد یا خارج این سیستم شود.
- در حالت تعادل، سیستم پویا است؛ گویی در مقیاس ماکروسکوپی به نظر میرسد هیچ اتفاقی نیفتاده است اما در مقیاس ریز، تغییرات برگشتپذیر به طور متوالی روی میدهند.
تعادل فیزیکی شامل تغییرات خواص شیمیایی مواد مرتبط با واکنش نیست. برای نمونه، تعادل بخار آب با خود آب در یک بطری در بستهی نیمه پر یک تعادل فیزیکی است زیرا مولکولهای آب فقط از مایع به بخار تبدیل میشوند.
تعادل شیمیایی با تغییر در ترکیب شیمیایی مواد، شکستن و تشکیل پیوند مرتبط است. یک مثال برای این تغییر، تجزیهی اسید استیک است. مبادلهی ذرات بین یونها و مولکولها در این تجزیه وجود دارد؛ زمانی که تعادل حاصل میشود، آهنگ مبادلهی ذرات بین یونها و مولکولها مساوی میشود.
مثال 1 از تعادل فیزیکی : تا مرحلهی 3، آهنگ تبخیر و آهنگ میعان کاملاً با هم متفاوتند و عمل تبخیر، بیشتر صورت میگیرد اما با گذشت زمان، میعان هم رو به افزایش است. در مرحلهی 3 و 4 آهنگ تبخیر و آهنگ میعان برای هر تغییر فیزیکی برابرند.
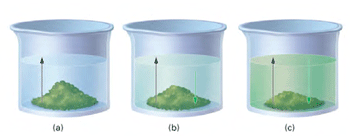 |
در حالت (c) آهنگ رفت (حل شدن مادهی جامد در حلال) و آهنگ برگشت (بلوری شدن مادهی حل شونده) در تعادل فیزیکیاند.

سؤال: در یک سیستم تعادلی، چه چیزهایی مساوی یا متعادل هستند؟
- لزومی ندارد غلظت مواد در تعادل، کاملاً مساوی باشد.
- فرایند هابر را به خاطر بسپارید (ساخت مواد خام و اولیه برای کود شیمیایی):

- در فشار و دمای اتاق، این واکنش تقریباً با هیچ NH3 در تعادل نیست.
- آهنگ تغییر در مسیر رفت واکنش (از چپ به راست معادله) با آهنگ برگشت (از راست به چپ) با هم مساویاند.
آهنگ واکنش
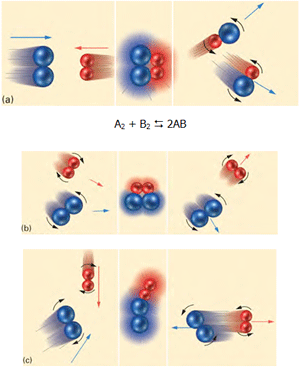
با استفاده از نظریهی برخورد در واکنشهای شیمیایی میتوان این مطلب را درک کرد. یک تغییر شیمیایی که به طور ماکروسکوپی قابل مشاهده است، نتیجهی تعداد زیادی از برخوردها مابین ذرات واکنش دهنده است. در شکل زیر و در حالت a، مولکولهای آبی و قرمز به دلیل اینکه انرژی جنبشی کافی و جهت مناسب دارند، واکنش انجام میگیرد. در حالت b با اینکه مولکولها جهت مناسب دارند ولی انرژی جنبشی کافی ندارند، واکنش انجام نمیگیرد. در حالت c مولکولها در برخورد با هم انرژی جنبشی کافی دارند اما جهتگیری آنها مناسب نیست؛ پس در این حالت نیز واکنش انجام نمیگیرد.
حال ببینیم تغییرات انرژی در طول واکنش به چه صورت است:
انرژی لازم برای واکنش (ΔE ) است. برای تشکیل محصولات، بایستی کمپلکسی از مجموعه ذرات فعال در واکنش با انرژی بالا نیز تشکیل شود. کمپلکس فعال شده، نوعی حالت واسطهی مولکولی است که در حین برهمکنش (برخورد) مولکولهای در حال واکنش با یک تغییر شیمیایی تشکیل میشود؛ بالاترین مقدار انرژی در حین واکنش به این حالت اختصاص دارد.
انرژی فعال سازی (Ea) کمترین انرژی جنبشی لازم برای تولید انرژی برخورد مؤثر است و با این انرژی میتوان به بالای تپه رفت!!!
نیوتن جاذبه را به خاطر افتادن سیب بر روی سرش کشف کرد. این داستان را همیشه در مدرسه ها می شنیدیم که نیوتن عزیز زیر درخت سیب نشسته بوده و سیبی که در همان اثنا روی سرش می افتد او را به فکر می اندازد و نهایتا قانون جاذبه توسط او کشف می شود. اما واقعیت این است که خود نیوتن هیچگاه این داستان را مطرح نکرده است و این داستان چندین دهه پس از کشف قانون نیوتن و بعد از مرگ وی بر سر زبانها افتاد. شاید این داستان را باید بزرگترین دروغی که در مدرسه ها به ما گفته اند نام گذاشت.

۲- فصل ها بخاطر نزدیکی زمین به خورشید بوجود می آیند. به ما یاد دادند که بخاطر تغییر فاصله زمین از خورشید فصل ها از بهار به تابستان، پاییز و زمستان تغییر می کنند. این افسانه غلط است. در واقع در بسیاری از شهرها در فصل تابستان، فاصله بین زمین و خورشید، بیشتر از فصل های دیگر است. تحقیقات علمی این نکته را اثبات کرده اند که تغییر فصول بدلیل تغییر زاویه زمین بر روی محور خود ایجاد می گردد. هنگامی که زمای به صورت عمود بر خورشید قرار می گیرد تشعشع بیشتری را نیز دریافت می کند.

۳- سیاه چاله هر چه در اطرافش باشد را می خورد. (به درون خود می کشد) در مدرسه تصور شرورانه ای از سیاه چاله به ما دادند و می گفتند که سیاه چاله هر شئ اطرافش را بدرون خود می کشد. اما این تمام حقیقت نیست. سیاه چاله اجسام را به داخل خودش می کشد اما نه لزوما همه اجسام. به دلیل گرانش بالا در سطج سیاه چاله عمل کشش به سمت سیاه چاله رخ می دهد اما همواره این گرانش بر گرانش دیگر ستاره ها برتری نخواهد داشت.

۴- دیوار چین از کره ما قابل رویت است. این داستان هیچ گاه به اثبات نرسید و در هیچ تصویر گرفته شده از خارج زمین، دیوار چین را نمی توان دید.

۵- هشت لیوان آب در طول روز برای سلامتی ضروری است. این یک باور عمومی است که برای زنده ماندن حتما می بایست آب خورد. و روزی هشت لیوان آب را ضروری می دانستند. اما واقعیت کمی متفاوت تر است. به منظور حفظ هیدراته بدن، می توانیم از نوشیدنی های دیگر نظیر میوه، آب میوه و سبزیجات استفاده کنیم که نیاز بدن به آب را تا حدودی تامین می کنند. بنابراین صرف ضرورت نوشیدن روزی هشت لیوان آب کاملا اشتباه می باشد.

۶- مغز انسان دارای حواس پنج گانه است. این واقعیت که مغز انسان دارای پنج حس بینایی، بویایی، چشایی، شنوایی و لامسه است را همه در مدرسه ها آموخته ایم. اما این نیز یک فریب علمی بزرگ است. چرا که دانشمندان معتقدند مغز انسان دارای حواس دیگری نظیر حس تعادل، سرعت، گرسنگی، خارش، اکستراپولیت درد، اکستراپولیت حرارت (اکستراپولیت به این معنی است که شما قسمتی از موضوع را بدانید و بقیه آنرا بتوانید پیش بینی کنید. این مورد در نمودار های تحلیلی بسیار کاربرد دارد که نرم افزارهای محاسبه گر ادامه نمودار را با توجه به قسمت های موجود نمودار اکستراپوله می کنند) و … می باشد. دانشمندان معتقد به این قضیه، حواس انسان را بین ۹ تا ۲۰ حس متغییر دانسته اند.

۷- همه انسانها متفاوت هستند. در تعالیم مدرسه این افسانه قهریه را آموختیم که چون انسانها شیوه آموزش متفاوت دارند لذا با یکدیگر متفاوت هستند. اما تحقیقات و آزمایشات علمی حقیقت دیگری را به اثبات رسانده اند. حقیقت این است که انسانها هنگام قرار گرفتن در معرض موارد مشابه، رفتار یکسانی را نشان می دهند. و با توجه به تحقیقات تنها ویژگی های ظاهری بسیار از انسانها متفاوت می باشد اما ویژگی رفتاری آنها در شرایط مشابه، یکسان است. (خوانندگان عزیز توجه نمایند که صحبت از تفکر جمعی می باشد و وجود استثناء در اینگونه تحقیقات کاملا طبیعی است و چه بسا تایید کننده صحت آزمایش).

۸- گاز CO2 آلاینده است و مضر. حتما بیانیه های مختلف در مورد کاهش مصرف گاز دی اکسیدکربن جهت کنترل گرمایش زمین، کمک به محیط زیست شنیده اید و همگی متفق القول از تاثیر منفی این گاز بر محیط زیست و سلامتی و آلودگی های آن صحبت کرده اند. اما حقیقت بازهم کمی متفاوت تر است. CO2 مسئول اینهمه آلودگی نیست. حدود ۸۰% از اتمسفر را گاز نیتروژن تشکیل داده است. اگه این مقدار بیشتر بود، بعنوان مثال اگر ۱۰۰% آن نیتروژن بود ما دیگر قادر به زندگی بر روی زمین نمی بودیم. حیات بر روی کره مین بدون وجود CO2 نیز غیر ممکن است چرا که گیاهان برای رشد و نمو نیاز به دی اکسید کربن دارند. در واقع مواد سمی صنایع مخلوط شده با CO2 مسئول آلودگی آن است.

۹- خفاش کور است. در کلاس های درس آموختیم که خفاش ها کور هستند. اما درست نیست چرا که خفاش ها از سیستم Biosonar برای شناخت دنیای پیرامون خود استفاده می کنند. خفاش با دریافت پژواک صدای فرستاده شده می تواند موقعیت تمامی اشیاء اطرافش را تشخیص دهد. این سیستم تشخیص اشیاء بسیار دقیق و پیچیده است و شاید بهتر بود بجای لفظ کور برای سیستم بینایی پر برکت(نمی دونم چرا این اصطلاح را نوشتم!) خفاش، اصطلاح بهتری را به کار می بردند.

۱۰- صدای اردک اکو نمی شود. (کواک کواک) خوب یادم هست که آموخته بودم صدای اردک ها اکو نمی شود. اما در آن روزگاران مثل بقیه آموخته هایم هیچ علاقه ای به دانستن دلیلش نداشتم. اما امروز دارم و میدانم! صدای اردک اکو می شود و مسئله این است که گوش ما انسانها قادر به شنیدن صدای اکو آن نیست. دانشمندان با طراحی اتاق مخصوص توانستند پژواک صدای اردک را بشنوند

شاد باشید و سلامت.
نرم افزار تبدیل آحاد و واحد های مهندسی
با استفاده از این نرم افزار تقریباً تمام واحدهای مهندسی رو فقط با یک کلیک میتونید انجام بدین.
موفق باشید.
دانلود مقاله درباره ساروج در ادامه مطلب
دانلود کتاب استاتیک و حل المسائل آن در ادامه مطلب

جیوه قرمز در ادامه مطلب
|
نام عمومی |
نام شیمیایی |
|
استن |
دی متیل کتن |
|
اسید شیرین |
اسید اگزالیک |
|
الکل،آب جو |
اتیل الکل |
|
الکل چوب |
متیل الکل |
|
زاج سفید |
آلومینیوم پتاسیم سولفات |
|
آلومین |
اکسید آلومینیوم |
|
آنتی کلر |
تیوسولفات سدیم |
|
محلول آمونیاک |
محلول آبی هیدروکسید آمونیم |
|
تیزاب سلطانی |
نیتروهیدروکلریک اسید |
|
جوهر شوره |
نیتریک اسید |
|
ترکیب آروماتیکی آمونیاک |
آمونیاک در الکل |
|
پنبه نسوز |
سیلیکات منیزیم |
|
اسپرین |
استیل سالسیک اسید |
|
جوش شیرین |
بی کربنات سدیم |
|
روغن موز |
ایزوآمیل استات |
|
بنزن |
بنزن |
|
کلرید جیوه |
کلرید جیوه |
|
اکسید مس سیاه |
اکسید مس |
|
سرب سیاه |
گرافیت |
|
پودر سفید گری |
آهک کلریدی |
|
زاج آبی ،جوهرگوگرد |
سولفات مس |
|
کات کبود |
سولفات مس |
|
براکس |
برات سدیم |
|
گوگرد |
سولفور |
|
آب نمک |
محلول آبی کلرید سدیم |
|
روغن آنتیموان |
تری کلرید آنتیموان |
|
روغن قلع |
انیدرید استانیک کلراید |
|
کالومل –جیوه سفید |
کلرید جیوه |
|
کربولیک اسید |
فنل |
|
گاز اسید کربنیک |
دی اکسید کربن |
|
پتاس سوز آور |
هیدروکسید پتاسیم |
|
سود سوز آور |
هیدروکسید سدیم |
|
گچ |
کربنات کلسیم |
|
شوره |
نیترات سدیم |
|
زاج سفید-آب ورشو |
سولفات پتاسیم کرومیک |
|
آب ورشو |
کرومات سرب |
|
زاج سبز |
سولفات فرو |
|
کرم تار تار |
پتاسیم بی تارتارات |
|
پودر سنباده |
اکسید آلومینیوم ناخالص |
|
نمک فرنگی –سولفات دومنیزی |
سولفات منیزیم |
|
اتانول |
اتیل الکل |
|
فلوریت |
فلورید کلسیم طبیعی |
|
فرمالین |
محلول آبی فرمالدئید |
|
گچ فرانسوی |
سیلیکات منیزیم طبیعی |
|
سرب معدنی |
سولفید سرب طبیعی |
|
نمک سولفات دوسود |
سولفات سدیم |
|
سنگ گچ |
سولفات کلسیم طبیعی |
|
هیدروسیانید اسید |
سیانیدهیدروژن |
|
هیپو |
محلول تیوسولفات سدیم |
|
آهک |
اکسید کلسیم |
|
آهک |
هیدروکسید کلسیم |
|
آب آ هک |
محلول آبی هیدروکسید کلسیم |
|
سنگ جهنم |
نیترات نقره |
|
منیزی |
اکسید منیزیم |
|
اکسید جیوه |
اکسیدجیوه |
|
متانول |
متیل الکل |
|
الکل متیلی |
متیل الکل |
|
جوهرنمک |
هیدروکلریک اسید |
|
روغن زاج |
اسید سولفوریک |
|
روغن وازلین |
متیل سالسیلات |
|
حشره کش |
استوارسنیت مس |
|
پودر سفید |
پودر کربنات کلسیم |
|
روغن گلابی |
ایزوآمیل استات |
|
خاکستر مروارید |
کربنات پتاسیم |
|
گچ |
سولفات کلسیم |
|
مغز مداد |
گرافیت |
|
پتاس |
کربنات پتاسیم |
|
پتاس |
هیدروکسید پتاسیم |
|
اسید پروسیک |
سیانید هیدروژن |
|
پیرو |
تتراسدیم فروفسفات |
|
آهک زنده |
اکسید کلسیم |
|
مرکوری |
جیوه |
|
سرب قرمز |
تترااکسید سرب |
|
نمک روشل |
تارتارات سدیم پتاسیم |
|
زنگ آهن |
اکسید فریک |
|
الکل چوب پنبه |
ایزوپروپیل الکل |
|
نمک آمونیاک |
کلرید آمونیم |
|
نمک قلیا |
کربنات سدیم |
|
نمک سفره |
کلرید سدیم |
|
نمک لیمو |
اگزالات مضاعف پتاسیم |
|
نمک تارتار |
کربنات پتاسیم |
|
شوره |
نیترات پتاسیم |
|
سیلیس |
دی اکسید سیلیکون |
|
خاکستر قلیا-جوش شیرین |
کربنات سدیم |
|
آب قلیلایی |
هیدرو کسید سدیم |
|
لیوان آب |
سیلیکات سدیم |
|
آب آمونیاک |
محلول هیدروکسید آمونیم |
|
شکر |
شکر |
|
طلق-تالک |
سیلیکات منیزیم |
|
سرکه |
اسید استیک رقیق ناخالص |
|
ویتامین ث |
اسید اسکوربیک |
|
کربنات سدیم آبدار |
کربنات سدیم |
|
آبگینه |
سیلیکات سدیم |
نوشتن آرایش الکترونی عناصر در ادامه مطلب
کتاب نکات کلیدی درس مکانیک سیالات
در این پست کتاب نکات کلیدی درس مکانیک سیالات رو برای کنکوری های دوره کارشناسی و کارشناسی ارشد جهت دانلود آماده کردیم که میتونید از ادامه مطلب دانلود کنید.
در این پست جزوات دست نویس پارسه رو جهت شرکت در آزمون کارشناسی ارشد مهندسی شیمی و غیره با موضوعات زیر میتونید از ادامه مطلب دانلود کنید:
1- مکانیک سیالات
2- انتقال حرارت
3- ترمودینامیک
4- کنترل فرایند
5- جرم و عملیات واحد
6- طراحی راکتور
7- ریاضیات

جهت مشاهده و دانلود به ادامه مطلب بروید.

در این پست بحث سرعت واکنش مطرح شده که به زبان انگلیسی هستن و همچنین پاسخ سوالات مطرح شده در متن مقاله هم در فایلی جداگانه آماده دانلود شده که میتونید از ادامه مطلب دانلود کنید.
کتاب شیمی فیزیک بارو – اتکینز یکی از منابع بسیار معتبر شیمی فیزیک برای اساتید و دانشجویان رشته شیمی می باشد.
اکنون نسخه ترجمه شده و فارسی آن با فرمت PDF تقدیم علاقمندان می گردد. برای دانلود این کتاب به ادامه مطلب مراجعه نمایید.

توضیحات بیشتر در ادامه مطلب
دوستان عزیز جهت آشنایی با کالریمتر یا گرماسنج روی لینک زیر کلیک کنید و گام به گام با گرماسنج آشنا شوید و در صورت تمایل تمرینات داده شده را نیز برای آشنایی بیشتر حل کنید.

یک نرم افزار بسیار قدرتمند در زمینه الکتروشیمی .
این نرم افزار قادر است از میان ۲۸۲۰۰۰ واکنش الکتروشیمیایی ممکن سیستم اکسایش – کاهش انتخابی شما را به سرعت تجزیه و تحلیل نموده و امکان وقوع آن را بررسی نماید و در صورت امکان انجام فرآیند اطلاعات کافی را به شمامی دهد .
به کلیه دوستداران الکترشیمی استفاده از این نرم افزار اکیدا توصیه می شود .برای دانلود به ادامه مطلب بروید

دانلود در ادامه مطلب
بنزن :
بنزن مایعی است بیرنگ و خوشبو که در تولید صنعتی گروهی از مواد مانند پلی استیرن،لاستیک مصنوعی و نایلون استفاده میشود.این مایع در تهیهٔ شویندهها و رنگها نیز به کار میرود.
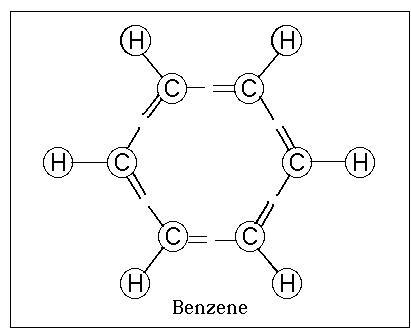
ساختار بنزن :
بنزن
متعلق به خانوادهٔ هیدروکربنهاست که هر مولکول آن ۶ اتم کربن و ۶ اتم
هیدروژن دارد که یک آرایش حلقوی را بهوجود میآورند. این آرایش حلقهٔ بنزن
نامیده میشود که در بسیاری از ترکیبات از جمله آسپیرین و مادهٔ منفجرهٔ
تی.ان.تی نیز وجود دارد. بنزن سمی و سرطانزا است.بنزن در طبیعت به دو
ساختار صندلی و قایقی وجود دارد که ساختار صندلی ان غیر قطبی بوده و ساختار
قایقی قطبی میباشد.
تاریخچه :
بنزن
را مایکل فارادی در سال ۱۸۲۵ میلادی کشف کرد.بنزن در ابتدا از طریق حرارت
دادن و قطران زغالسنگ و سپس تبدیل بخار آن به مایع بهدست میآمد اما
امروزه بنزن را به مقدار زیاد از نفت خام استخراج میکنند.
ساختار بنزن توسط فردریش آگوست ککوله شناسایی شد.
ویژگیهای بنزن :
مایع بی رنگ ، معطر و دارای رایحه خوب، بسرعت بخار می شودو دارای قابلیت اشتعال فوق العاده بالا است این ماده در مواد پلاستیک ، رزین ،نایلون ، روغن های روان ساز،مواد رنگی،پاک کننده ها سموم آفت کش و..موجود است
چگونه در معرض آن قرار می گیریم؟
*استنشاق از طریق : بخارات و مقدار کمی ازآن در دود سیگار
*بلعیدن : از طریق منابع آب زیر زمینی آلوده
• تماس و جذب از راه پوست
• اثرات استنشاق بنزن:
• خواب آلودگی ، گیجی ، افزایش ضربان قلب ، سر درد ، رعشه و لرزش، عدم شناخت و سر گیجه غش کردن و بیهوش شدن و مـــــر گــــــــــــ اثرات خوردن بنزن از طریق آب یا غذای آلوده : تهوع و استفراغ ،سوزش معده ،سرگیجه وعدم تعادل ، سستی و خواب آلودگی ،تشنج افزایش ضربان قلب ومـر گ
• اثرات تماس بنزن : قرمزی ، زخم شدن وجراحات دردناک ، سوزش و ناراحتی چشم
اثرات مزمن وطولانی مدت بنزن
• کاهش خون سازی بدن ناتوانی در سیستم دفاعی بدن سرطان : سرطان خون لوسومی اختلال در سیستم تنفسی تاخیر در استخوان بندی جنین انسان صدمه به سیستم تولید مثل انسان و به سمت عواقب نا باروری تومورهای غدد لنفاوی و صدمه به کبد
• راههای تشخیص :
• 1. تست ریه و تنفسی – فقط در مواردی که بسرعت پس از تماس انجام شود ودر موارد آلودگی با مقدار پایین جواب گو نیست 2.تست کامل فا کتور های خون و مغر استخوان آنهم سریعا پس از آلودگی چون بسرعت در خون واکنش داده ومحو می گردد لذا بایستی سریعا پس از مواجه با آن آزمایشات خونی شامل فاکتورهای انجام پذیرد : WBC, Granulocytes, Lymphocytes CD4-T cells,CD8-T cells,CD4/CD8, B cells,NK cells, Monocytes,Platelets, Hemoglobin
چندین موسسه از جمله انجمن تحقیقات سرطان دنیا ، انجمن حفظت محیط زیست
امریکا ،اداره خدمات بهداشت امریکا ، بنزن ، را عامل سرطان خون (لوسمی) و
دارای درجه سرطان زای 1 معرفی کرده اند. دوره مرحله پنهانی سرطان خون بطور
معمول 5 تا 15 سال بعد از اولین تماس رخ می دهد.
•
سرطان خون :
•
لوسمی به معنای سرطانی شدن سلولهای خونی می باشد که معمولاً در بین رده
های خونی ، گلبولهای سفید بیشتر تمایل به سرطانی شدن دارند. سلولهای سرطانی
در مقایسه با سلولهای خونی طبیعی متفاوت بوده و عملکرد طبیعی خود را نیز
از دست داده اند.
• سرطانهای خونی خود به دو دسته تقسیم می شوند که هر کدام از آنها خود به دو صورت حاد و مزمن تظاهر می یابند.
• در لوسمی حاد، سلولهای اولیه و نابالغی که اصطلاحاً بلاست نامیده می
شوند به تعداد زیاد در گردش خون وجود دارند که معمولاً بسیار نابالغ بوده
فاقد عملکرد طبیعی هستند. سرعت تکثیر این سلولها بسیار بالا می باشد و
بیماری به سرعت گسترش می یابد.در لوسمی مزمن نیز سلولهای بلاستی وجود
دارند اما این سلولها بالغ تر بوده و قادر به انجام بعضی اعمال خود می
باشند. در این حالت سلولها آرامتر رشد می کنند و پیشرفت بیماری کندتر می
باشد.
• علائم ذیل از جمله معمولترین علائم سرطان خون می باشد، اما ممکن است هر فردی علائم دیگری نیز داشته باشد :
• افزایش میزان ابتلا به عفونتها و تب ، کم خونی و علائم مربوط به آن
شامل رنگ پریدگی پوست ، خستگی و ضعف ، خونریزی ، کوفتگی و خونمردگی، تب و
لرز ، کاهش اشتها، کاهش وزن ، تورم غدد لنفاوی، کبد و طحال بزرگ و دردناک،
لکه های قرمزرنگ تو پر پوستی، تورم و خونریزی از لثه ها ، تعریق و درد
استخوانها و مفاصل، می باشند.
• سایر اختلالات خونی و یا بعضی داروها نیز ممکن است علائم مشابهی ایجاد کنند . لذا در صورت مشاهد این علائم به پزشک مراجعه نمائید
• علاوه بر اخذ تاریخچه کامل و انجام معاینات لازم روشهایی تشخیصی انواع
سرطانهای خون شامل موارد ذیل است. معاینه و ارزیابی بزرگ شدن کبد، طحال ،
غدد لنفاوی پشت آرنج ، کناره ران و گردن
• - انجام آزمایشهای خونی و سایر آزمایشات لازم - آزمایش خونی برای
ارزیابی تعداد سلولهای خونی نابالغ ( بلاستها) - نمونه گیری مغز استخوان -
نمونه گیری از مایع کمری -روشهای تصویر برداری نظیر عکسبرداری ،
سونوگرافی و سی تی اسکن
• روشهای درمانی
• استفاده از روشهای درمانی خاص برای یک بیمار بر عهده پزشک می باشد و براساس سن، سلامت عمومی و تاریخچه پزشکی بیمار، وسعت بیماری، میزان تحمل بیمار در مقابل داروها یا روشهای درمانی خاص ، انتظاری که از سیر بیماری وجود دارد و نظر و ارجحیت خود بیمار می باشد.
•
روشهای درمانی شامل موارد ذیل است : شیمی درمانی، پرتو درمانی، پیوند
سلولهای بنیادی مغز استخوان، درمان بیولوژیکی، تزریق خون و استفاده از
داوهایی که مانع از تخریب سایر سیستمهای بدن تحت تأثیر انتشار سرطان می
شوند .
• علل و عوامل خطرساز :
•
از جمله علل و عوامل خطر سازی که منجر به افزایش احتمال به سرطان خون می
شوند می توان به قرار گرفتن در معرض اشعه ها، تماس با مواد شیمیایی نظیر
بنزن که در محیطهای کاری بیشتر رخ می دهد و استنشاق از طریق هوای آلوده در
شهرها می باشد.،
• استاندارد غلظت بنزن مطابق جدول ذیل ، مرجع مختلف استانداردهای متفاوتی
برای محیط های مختلف ذکر نموده اند ، بطور مثال برای محیط کارخانه در
ساعات کاری 8 ساعته مقادیر 0.5و 0.1 و 1 ذره در میلیون بیان کرده اند
تحقیقات پزشکی ناشی از بنزن :
•
در جدول بعدی تحقیقاتی که سال 2005 در مورد اجزا و 11فاکتور خون و همچنین
ادرار در مورد 390 نفر شامل 140 نفردر محیط کنترل شده و 250 نفر در محیط
آغشته به بنزن با سطوح مختلف را نشان می دهد.
• چگونه ریسک خطر را کاهش دهیم :
1. پایش و اندازه گیری بنزن موجود در هوا بوسیله سنسورهای مخصوص بنزن و موادآروماتیکی و تطابق با استانداردها و پیدا کردن ورفع نشتی های احتمالی ومشخص نمودن میزان ریسک خطر بنزن موجود در هوا
2. استفاده لباس کامل کار ضد مواد شیمیایی که سیستم تنفسی داخل لباس است،دستکش و چکمه مخصوص و ماسکهای تمام صورت فشار مثبت SAR,SCBA
3.ایجاد اتوشویی ورخت کن
ایزوله جهت تعویض لباس کار پرسنل هنگام ورود و خروج از مجتمع و استحمام
برای نفرات در معرض مستقیم بنزن قبل از خروج از محل کار بردن لباس کار به
منزل یعنی احتمال آلوده کردن فرزندان وخانواد ها !!
5. ایجاد سیستم بارگیری اتوماتیک بدون دخالت نفر و چک میزان بنزن قبل از بارگیری
6. تنها افرادي اجازه حضور در محل كار شيميايي را داشته با شند كه به آنها مربوط مي شود. بايد از توفقهاي بيهوده جلوگيري شود
7. معاینات کامل دورهای شش ماهه برای پرسنل و دو سال یکبار برای خانوادها جهت تست کامل سرطان خون
8. تغذیه سالم با مواد گیاهی و سبزیجات ولبنیات و ورزش به سلامتی پرسنل شاغل کمک شایانی می نماید .
9. کم کردن ساعات کار در معرض موادآروماتیکی
10. دوره های منظم و مداوم آموزشی آشنایی با انواع مختلف مواد شيميايي و اصول بهداشت کار در مجتمع های پتروشیمی به ویژه آروماتیک ها
11.مدیریت پسماند مواد شیمیایی و جمع آوری ظروف و موادآلوده از سایت
12. ایجاد علائم و هشدارها و دستور العمل های ایمنی در مکانهای لازم
13. رعایت نکات کامل ایمنی در هنگام کارهای تعمیراتی و بخصوص در تعمیرات اساسی و جلوگیری از نشتی های احتمالی .
منبع :
1 .بهداشت عمومی ،دکتر منصور غیاث الدین ،دانشگاه علوم پزشکی تهران*
2- کتاب پتروشیمی – دکتر خسروی
این پست نمونه سوالات و راهنمای تصحیح امتحانات نهایی سالهای 86تا90 رشته صنایع شیمیایی و در ادامه مطلب رشته کامپیوتر و حسابداری قرار داده شده است.تمامی فایلها با فرمت Word و PDF هستند که برای اجرای آنها به نرم افزارهای ورد و adobe acrobat نیاز دارید.برای دانلود روی نام هر گزینه کلیک کنید.
دانلود کل نمونه سوالات صنایع شیمیایی از سال 86تا90قسمت اول
دانلود کل نمونه سوالات صنایع شیمیایی از سال 86تا90قسمت دوم
دانلود بصورت تک درس:
دانلود بصورت تک امتحان با تاریخ مشخص:برای دانلود روی نام هر گزینه کلیک راست کنید و آن را دریافت و ذخیره کنید.
1- ریـــــاضی
1- دی ماه
سال86 سال87 سال 88 سال89 سال 90
2- شهریورماه
سال86 سال87 سال 88 سال89 سال 90
3- خردادماه
سال86 سال87 سال 88 سال89 سال 90
2- دیـــــن و زنــــــــدگـــی
1- دی ماه
سال86 سال87 سال 88 سال89 سال 90
2- شهریورماه
سال86 سال87 سال 88 سال89 سال 90
3- خردادماه
سال86 سال87 سال 88 سال89 سال 90
3- فرایــــــــندهای شیمـــــــــیایـــــــــــی
1- دی ماه
سال86 سال87 سال 88 سال89 سال 90
2- شهریورماه
سال86 سال87 سال 88 سال89 سال 90
3- خردادماه
سال86 سال87 سال 88 سال89 سال 90
4- عــــــــملیـــــــــــات دستگاهـــــــــــی
1- دی ماه
سال86 سال87 سال 88 سال89 سال 90
2- شهریورماه
سال86 سال87 سال 88 سال89 سال 90
3- خردادماه
سال86 سال87 سال 88 سال89 سال 90
5- شیــــــــــمــــی تجـــــــــــزیه
1- دی ماه
سال86 سال87 سال 88 سال89 سال 90
2- شهریورماه
سال86 سال87 سال 88 سال89 سال 90
3- خردادماه
سال86 سال87 سال 88 سال89 سال 90
سوالات رشته های حسابداری و کامپیوتر در ادامه مطلب
لطفاً هر گونه اشکال در لینکها را گزارش کنید؛با تشکر

در این بخش گزارش کار آزمایشگاه عملیات واحد مهندسی شیمی را با مضوعات زیر در ادامه مطلب قرار دادیم که میتونید دانلود کنید.
۱-استخراج از جامدات
۲-برج آکنده
۳-برج تبخیر کننده
۴-برج خنک کننده
۵-جذب گاز
۶-خشک کن دوار
۷-راکتور شیمیایی
۸-سنجش نفوذ ملکولی

- تعاریف
- خواص ماده ساده تراکم پذیر
- کار و گرما
- قانون اول ترمودینامیک
- قانون دوم ترمودینامیک

دانلود جزوه ریاضی 1 و 2 دانشگاه صنعتی شریف
دانلود از ادامه مطلب
دریافت گزارش کار آزمایشگاه شیمی تجزیه ١ در ادلمه مطلب؛این سری گزارش کار شامل موضوعات زیر میباشد:
1-تیتراسیون اسید - باز
2-اندازه گیری حجمی منیزیم توسط E.D.T.A
3-اندازه گیری کلسیم و منیزیم توسط E.D.T.A (سختی آب)
4-اندازه گیری NaHCO3 و Na2CO3 در یک محلول
5-سنجش حجمی آهن توسط پرمنگنات سدیم
6-محلول های سنجیده در واکنش های رسوبی
7-سنجش یون کلرور بطریقه ی ولهارد
8-تیتراسیون های اکسایش-کاهش ( یدومتری )
9-گراویمتری ( وزن سنجی رسوب )
كاربرد بیوتكنولوژی در استحصال نیكل و كبالت
اكثر كانی های سولفیدی فلزات پایه از روش بیولیچینگ قابل استحصال هستند. در خیلی از موارد، فلزات پایه گرانقیمتی مثل Co، Zn، Ni از فلزات بی ارزشی چون پیریت قابل استحصال هستند. در قدیم به خاطر عدم وجود تكنولوژی لازم، پایین بودن قیمت فلزات و كمبود تجربه صنعتی برای استحصال این فلزات از مواد معدنی با عیار پایین اصلا استفاده نمی شده است. از وقتی كه طلای مقاوم توسط روش میكروبی قابل استحصال شده، توجه به فلزاتی از جمله روی، نیكل و دیگر فلزات پایه معطوف شده است. به علاوه، تكنولوژی لازم برای بازیابی از محلول ها نیز در حال گسترش است. به طور مثال، امروزه بازیابی روی از محلول حاوی ۵-۱ گرم بر لیتر روی امروزه توسط روش SX-EW به رغم اینكه قیمت این محلول ها به ازای واحد فلزات بازیابی شده نسبت به مس بالاتر است، امكانپذیر می باشد.
لطفا ادامه مقاله را در ادامه مطلب بخوانید
عنوان : اندازهگیری گازهای خطرناک و سمی
اندازهگیری گازهای خطرناک روز به روز در صنعت امروز اهمیت بیشتری پیدا میکند. کارخانهها کمیتهای برای ایجاد استانداردهای محیطی تشکیل دادهاند و شرایط و استانداردهای بسیار سختگیرانهای برای جلوگیری از انتشار این گازها تعیین شده است. ABB(uk) سیستمی دایمی را پیشنهاد داده است که اندازهگیری گازها را با کیفیت بسیار بالا انجام میدهد و با اینکه هزینه بسیار اندکی را در طول دوره کار کارخانه تحمیل میکند، اما تحلیلگرهای NDIR و FTIR بسیار قدرتمندی دارد که توانایی مانیتورینگ خودکار و از راه دور را نیز دارد.
ادامه مقاله در ادامه مطلب بخوانید
نقش مهندسی شیمی در بیوتکنولوژی
همانطور که صنایع شیمیایی تا مدت زیادی فقط توسط شیمیستها (و نه مهندسان شیمی) مورد بررسی قرار میگرفت، فرآیندهای زیستی نیز هنوز توسط میکروبیولوژیستهای صنعتی مورد بررسی قرار میگیرد. بنابراین بسیاری از حوزههای بیولوژیکی وجود دارد که در آنها میتوان بهوسیلة کاربرد مفاهیم سادة مهندسی، فرایندهای بیولوژیکی را توسعه داد.
ادامه مقاله را در ادامه مطلب بخوانید
نرم افزار
دانلود نرم افزار Realtek PCIe GBE Family Controller [1]
نرم افزار gNMR [1]
35نرم افزار شیمی [1]
4نرم افزار مهندسی شیمی [1]
فونت ها و شکلهای شیمی در ورد [1]
جدول تناوبی [4]
شبیه سازی ساختار ملکولی شیمی با CrystalMaker v2.5.1 [1]
ماشین حساب مهندسی [2]
دانلود نرم افزار پیشگویی کننده واکنشهای شیمیایی (Chemical Predictor) [2]
نرم افزار تبدیل واحد [1]
شبيه سازي تعاملي PhET ( شبیه ساز رشته های علوم پایه ) [1]
دانلود بیش از ۳۰ شبیهسازی تعاملی [1]
نرم افزار Matlab [3]
دانلود «آشنای محبوب»؛ اولین فیلم آموزش روابط جنسی در ایران [2]
دانلود رایگان نرم افزار HyperChem v8.0.7 [1]
نرم افزار Fx Chem v2.104.2 [1]
نرم افزار مدل سازی نانو لوله های کربنی [1]
ISIS/Draw 2.5 [1]
آموزش جدول تناوبی با استفاده از بازی [1]
نرم افزار Chem Office [0]
نرم افزار CropWat v8.0 [1]
مجموعه دیکشنری مهندسی شیمی | مهندسی پلیمر | مهندسی نفت [1]
دانلود نرم افزار rfflow [1]
دانلود نرم افزار زیارت آنلاین حرم ائمه اطهار Ziarate Online 2.0 [1]
دانلود گنجور رومیزی ۲.۶ – نرم افزار اشعار شاعران فارسی زبان [1]
Proteus Professional 7.7 SP2 [1]
آموزش تصویری نرم افزار MATLAB [1]
نرم افزار شیمی معدنی [1]
شیمی - صنایع شیمیایی - مهندسی شیمی
انیمیشن های کاربردی شیمی [5]
جدول تناوبی و عملیات مختلف مهندسی شیمی [6]
ایمنی و بهداشت [5]
جزوه جرم و انرژی [1]
نانوتکنولوژی [9]
پالايشگاه نفت [1]
تاریخچه استخراج نفت در ایران [1]
کیک زرد (خاک معدنی اورانیوم) [1]
واکنش های شیمیایی [1]
وسایل آزمایشگاهی [3]
تصفیه نفت خام [0]
آب اکسیژنه [1]
آمونیفیکاسیون [1]
بهترین تصفیه خانه های ایران [1]
آلکنها در شیمی آلی [1]
هیدروکربن ها [1]
پمپ [1]
کاویتاسیون [1]
برج تقطیر (Distillation Tower) [1]
باکتری های نفت خوار، تهدیدی برای مخازن نفتی [2]
راکتورهای شیمیایی [2]
انواع لامپ های روشنایی [1]
ساختار اتم [1]
گوگرد [2]
جدول تبدیل واحد مهندسی شیمی [1]
روش ساخت مواد منفجره و سمی [6]
دانلود کتاب [52]
نسخه کامل کتاب شیمی عمومی-نویسنده: دکتر علی افضل صمدی [1]
راکتور ستونی حبابی [1]
کنترل دمای یک راکتور CSTR ناپایدار [1]
نیترات آمونیوم [1]
واکنش ترمایت و بررسی شیمیایی [1]
سلول بنیادی چیست؟ [1]
بمب کثیف [1]
آب سنگین چیست؟ [1]
تجزیه عنصری [1]
پتاسیم [2]
استراتژی مدیریت [1]
چطور میتوان نیترات آب آشامیدنی را کاهش داد؟ [0]
کامپوزیتها [1]
زئولیت [1]
رزینهای مبادله کننده یون [1]
هیدروژن پروکسید ( آب اکسیژنه) [1]
تهیه گاز کلر، سود سوزآور و گاز هیدروژن [1]
آهن و کانی های آهن [1]
بررسی ایزوتوپ های هیدروژن [1]
سولفوریک اسید [1]
نیتریک اسید و روش ساخت [1]
سیلیسیم و خالص سازی آن [1]
بررسی شیمیایی اکسیژن [1]
فرآیند تولید فولاد [1]
منیزیم ( Mg ) و بررسی شیمیایی آن [1]
تهیه اکسید آهن به روش الکترولیز [1]
طيفسنجي الكترون اوژه (AES) [1]
طيف سنجي فوتوالكترون پرتو اکس (XPS) [1]
آنالیز های ساختاری(XRD) [1]
لانتانیدها [1]
جزوه کنترل فرآیندها در مهندسی شیمی [2]
دانلود رایگان و با لینک مستقیم گزارش کار آزمایشگاه شیمی آلی [2]
عدد اتمی [1]
منگنز ( Manganese ) [1]
جزوه ی درسی کنکور -- پيش دانشگاهی [1]
پاورپوینت آموزشی شیمی [1]
جذب سطحی(Adsorption) [1]
انواع مبردها و بررسی مبرد R134a [2]
روشهای تولید بنزین [2]
جزوه اصول تقطیر [1]
دانلود 10 جزوه مهندسی شیمی [1]
گزارش کار آزمایشگاه کنترل فرآیند مهندسی شیمی [1]
بیوسنسورها [1]
جزوه کنترل فرایند 2 [1]
جزوه آوزشی پمپ های هیدرولیکی [1]
جزوه مکانیک سیالات [1]
گزارش کار آزمایشگاه مکانیک سیالات [2]
پاسخ سوالات کتاب اصول تصفیه آب چالکش امیری [1]
آهک و کاربردهای آن [1]
آلوئه ورا و خواص گیاه آلوئه ورا [1]
مقاله لوله های گرمایی و ترموسیفون ها [1]
مجموعه مقالات و کتاب های الکترونیکی در زمینه جنگ نرم و جنگ سایبری [2]
پاورپوینت هک و امنیت در فضای مجازی [2]
پاورپوینت جاسوسی در اینترنت و مقابله با آن [2]
پاورپوینت آموزشی جنگ سایبری [2]
انواع روغن کدامند؟ [1]
نقش مهندسی شیمی در بیوتکنولوژی [1]
اندازهگیری گازهای خطرناک و سمی [1]
كاربرد بیوتكنولوژی در استحصال نیكل و كبالت [1]
گزارش کار آزمایشگاه شیمی تجزیه ١ [3]
دانلود جزوه ریاضی 1 و 2 دانشگاه صنعتی شریف [1]
جزوه ترمودینامیک ۱ [2]
گزارش کار آزمایشگاه عملیات واحد مهندسی شیمی [1]
نمونه سوالات امتحان نهایی [2]
بنزن [1]
کالریمتر یا گرماسنج [2]
شیمی فیزیک اتکینز [2]
سرعت واکنش [2]
آشنايي با فرآوري هاي گازهاي CNG,LNG,LPG [2]
تنظیم نقطه شبنم گاز طبیعی [1]
جزوات پارسه [1]
دانلود کتاب فیزیک هالیدی ویرایش ۸ بهمراه حل المسائل [1]
کتاب نکات کلیدی درس مکانیک سیالات [1]
جیوه قرمز [1]
دانلود کتاب استاتیک و حل المسائل آن [1]
ساروج [2]
تعادل [4]
حذف فلزات سنگین از فاضلاب هاي صنعتی [1]
جزوه آموزشی پمپ های هیدرولیکی [1]
گزارشکار آزمایشگاه انتقال حرارت [1]
روتاری ولو [1]
گزارش کار آزمایشگاه کنترل فرآیند مهندسی شیمی [1]
نمودار دما- آنتروپي براي هوا [1]
شناخت آبهای صنعتی و روشهای تصفیه [1]
جزوه کاربرد ریاضیات در مهندسی شیمی [1]
پروژه تماس غشایی [1]
نانو کامپوزیت پلیمری [1]
گزارش کار های شیمی فیزیک [5]
تعيين غلظت سولفات آهن به روش منگانومتري [1]
تهيه دي بنزال استون [2]
تعیین نقطه جوش به روش میکرو [0]
گزارشکار تبلور مجدد ( نو بلور سازی ) [1]
فلزات سنگین [1]
سختی آب [1]
استخراج نقطه ابری [1]
دانلود کتاب آنالیز شیمیایی اینگل [1]
دانلود حل المسائل کتاب ریاضی مهندسی دکتر شیدفر [1]
دانلود کتاب ریاضی مهندسی دکتر شیدفر [1]
جزوه آموزشی Aspen Polymer [1]
متانول [1]
گوگرد زدايي در صنعت [1]
تعيين رنگ فرآوردههاي نفتي [1]
power point آشنایی بالوله واتصالات [1]
برج های خنک کننده - پاورپوینت [1]
دانلود جزوه درسی شیمی فیزیک [1]
پاورپوینت با موضوع کراکینگ [1]
معرف های شیمیایی [1]
یخ خشک (Dry ice) [2]
ديوكسين پايدارترين سم در محيط زيست [2]
مقررات ايمنی زيستی در آزمايشگاهها (ژنتيک پزشکي) [0]
حلال انواع لکه [2]
ويلرهای واترتيوب [1]
مجموعه کتاب های طرّاحی، کنترل فرآیند و تجهیزات فرآیندی [0]
مجموعه کتب انتقال حرارت [2]
Process Heat Transfer [1]
آزئوتروپ [1]
محفظه احتراق ریفرمر [1]
دی اکسید کربن محلول و PH و قلیاییت و سختی [1]
زرد کروم و نارنجی کروم [1]
فناوری نانو در تصفیه آب و فاضلاب [1]
جداسازی گازها با غشا [1]
تجزیه و تحلیل سیستم تبرید واحد آمونیاک به منظور کاهش مصرف انرژی [1]
جزوه مسائل حل شده انتگرال دوگانه [1]
معادلات دیفرانسیل1 [1]
جزوه استاتیک [1]
جزوه مکانیک سیالات [1]
روشهاي انتگرال گيري [1]
گزارش کار آزمایشگاه نفت [1]
جزوه کنترل فرآیند دانشگاه شریف [0]
ارزیابی نفت خام و روش های تفكیك (Condensate ) [2]
پروژه طرح و اقتصاد - نیتریک اسید [1]
مزايا و معايب Orifice Meter [0]
گاز از خام تا فرآورده [1]
شرح فرآیند مشعل (Flare) [2]
دستگاه احیاء مداوم کاتالیست (Continuous Catalyst Regeneration) [2]
کمپرسورهای سانتریفیوژ [2]
تجربیات مهندسین پالایشگاه اصفهان در حل مشکلات پیش آمده(Case Study) [2]
سیلیکاژل [2]
کمپرسورهای رفت و برگشتی [1]
منابع اتلاف انرژی در بویلرها و روش های بهینه سازی بویلر [1]
مجموعه مقالات دوازدهمين همايش بين المللي نفت و گاز [1]
معرفي والوها [2]
ضرايب معادله ي آنتوان براي محاسبه ي فشار بخار [1]
روشهاي انتگرال گيري [1]
روش های تولید بنزین [2]
خطرناكترين و كشنده ترين سم هاي جهان [1]
بمب دودزا [2]
نگهداري مواد خطر ناك [2]
ساختن موشك با استفاده از هيدروژن پري اكسيد و نقره [2]
آيا آرد (آرد گندم) ميتواند منفجر شود؟ [2]
حلال های فوق بحرانی در صنایع غذایی [1]
دانلود «آشنای محبوب»؛ اولین فیلم آموزش روابط جنسی در ایران [2]
تصفیه فراورده های نفتی [1]
مشتقات غیر هیدروکربنی نفت [1]
دانلود سوالات کنکور کاردانی صنایع شیمیایی [4]
دانلود رایگان کتاب آموزش سریع نرم افزار ChemOffice [1]
ارائه یک روش رنگ سنجی برای شناسایی متانول در نوشیدنی های مختلف [1]
نانو شیشه [2]
نانوتکنولوژی و صنعت نساجی [1]
مزایا ومضرات استفاده از گاز نیتروژن در تایر خودرو [1]
دانلود کتاب شیمی آلی [2]
دیکشنری/دایره المعارف برای شیمی آلی [1]
طیف سنجی مولکولی [2]
شیمی آلی 1 [1]
شیمی آلی 2 [1]
شیمی آلی 3 [1]
سنتز ترکیبات آلی [1]
چرا فنل فتالئین در محلول غلیظ باز بی رنگ میشود؟ [1]
دانلود گزارش کارآموزی رشته مکانیک و شیمی در پالایشگاه گاز [1]
دانلود پروژه دیگ بخار [1]
بررسی فعالیت کاتالیست های دو فلزی بر پایه ZSM-5 در واکنش کاتالیستی متان به بنزن [2]
آب شعله آفرین! [2]
شعله در گودی دست [2]
فشفشه قندی [1]
فواره آمونياكي [2]
طنز دوقلوهای افسانه ای در ایران [1]
بررسی فعالیت های مهندسی شیمی در حوزه فناوری نانو [1]
گاز کامل [2]
انواع دماسنج ها و طرز کار آنها (کاملترین مقاله دماسنج) [2]
نمونه سوالات طراحی راکتور [1]
نمونه سوالات کنترل فرآیند [1]
کتاب شیمی و تکنولوژی رنگ [1]
جزوه معادلات دیفرانسیل 1و2 [1]
دانلود رایگان جزوه حل مسائل حساب دیفرانسیل و انتگرال [1]
فرمول های مشتق دوره دبیرستان [1]
دانلود همه فرمول های شیمی دبیرستان [2]
دانلود کتاب دنیای نانو [1]
کتاب آزمایشگاه شیمی عمومی 1 [1]
کتاب شیمی تجزیه 1 [1]
شیمی آلی فلزی [1]
آزبست و جايگزين هاي آن در صنايع مختلف [1]
بررسی اجمالی پیگمانها، رزینها، بایندرها و کاتالیستها در صنایع رنگ سازی [1]
انواع دماسنج و طرز کار آنها [1]
تعیین عدد اکسایش یک اتم در ترکیب [2]
حل المسائل انتقال جرم مک کیب [1]
گزارش کار آزمایشگاه فیزیک 1 [1]
گزارش کار آزمایشگاه انتقال حرارت [2]
تولید صنعتی چسب [1]
اثرات MTBE در آلودگي منابع آب [2]
كاربردهاي مهندسي شيمي در پزشكي [1]
ولوهاي ديافراگمي(Diaphragm Valve) [1]
ولوهاي يكطرفه(CHECK VALVE) [1]
جست وجوى نقض اصول فيزيكى اينشتين [2]
شیمی عمومی (دکتر علی افضل احمدی) [1]
شیمی عمومی1 ( چارلز مورتیمر ) [1]
شیمی عمومی 2 (جوانبخت) [1]
شیمی آلی 1 [1]
شیمی آلی ولهارد [1]
اصول ابتدایی فرآیندهای شیمی به همراه حل المسائل [1]
راهنمای مواد شیمیایی و سیالات نفتی مهندسی نفت [1]
باتری های سرب اسید [1]
سمشناسی بشر از مخلوط مواد شیمیایی؛ چاپ دوم [1]
مونومرها، پلیمرها و مواد مرکب از منابع تجدیدپذیر [1]
مدادها و پاككن ها چگونه عمل ميكنند؟ [1]
جوهر نامريي [1]
فرمول نویسی و نامگذاری ترکیبات معدنی [2]
فرمول نویسی و نامگذاری ترکیبات معدنی [2]
نامگذاری سیکلو آلکان ها [2]
نامگذاری آلکن ها و آلکین ها [3]
نامگذاری ترکیبات آلی( آلکان ها) [1]
نمونه سوالات مبحث انحلال پذیری با پاسخ تشریحی [2]
گزارش آزمایشگاه خاک [1]
گزارش کار آزمایشگاه - اندازه گيری شدت جريان يا دبی در لوله ها [1]
دانلود گزارش کار آزمایشگاه - آشنایی با سر ریز تیغه ای و تعیین دبی عبوری از آن [1]
گزارش کار کارگاه عملیات دستگاهی [1]
دانلود کتاب شیمی فیزیک بارو – اتکینز به زبان فارسی [1]
موازنه کردن معادله واکنش های شیمیایی به روش وارسی [1]
سوالات مسابقات علمي عملي [2]
کشش سطحي آب [2]
معرفی 3 حالت ديگر ماده به جز جامد، مايع و گاز [2]
روش شناسایی فسفر در آب [2]
مجموعه ی جزوه های کمک آموزشی دسته بندی سؤالات هدفدار شیمی ۱ (عمومی) + پاسخ تشریحی [1]
قانون هس و محاسبه آنتالپی واکنش [1]
ترکیبات آلی کلردار و هالوآلکانها: دوست یا دشمن؟ [1]
رنگهای شعله و تركیبات شیمیایی [1]
تولید و ترکیبات شیمیایی شیشه [2]
آموزش آشنایی با روش های تفکیک و تخلیص ترکیبات آلی1 [2]
قوانین تغییرات شیمیایی [3]
قانون بقای جرم [1]
قانون نسبت های معین [2]
قانون سوم (قانون نسبتهای چندگانه) ( اضعافی ) [1]
دانلود هندبوک پری / Perrys.Chemical.Engineers.Handbook.7th.Ed [1]
حفظ کردن جدول تناوبی [1]
پاسخ خودآزمایی های شیمی آلی 2 [1]
دانلود دیكشنری تخصصی شیمی [1]
خلاصه درس شیمی تجزیه دستگاهی [1]
دانلود کتاب ریاضی 1 [1]
پاور پوینت دروس تخصصی رشته شیمی کاربردی [1]
مول [1]
الکتروشیمی [2]
اِستريفيكاسيون باکاتالیزاتوراسیدی [2]
کتاب طراحی راکتور لون اشپیل و حل تمرین آن [1]
برخی از ترکیبات مهم به همراه موازنه آنها [1]
کتاب شیمی آلی سولومونز [2]
حل المسئل شیمی آلی سولومونز [2]
کتاب آلومینیم و آلیاژهای آن [1]
کتاب شیمی معدنی میسلر و تار [1]
نامگذاری استرها [0]
مکانیسم تمام واکنشهای آلی [0]
مکانیسم تمام واکنشهای آلی [1]
ترمودینامیک ون وایلن [1]
حل المسائل ون وایلن (انگلیسی) [1]
حل المسائل ون وایلن (فارسی) [1]
براق کننده ی استیل [1]
جزوه آموزش شیمی ۲ [5]
جزوه آموزش شیمی 3 [3]
سؤالات امتحانهای کشوری شیمی اول [1]
باز تعریف آنتروپی از دیدگاه ماکروسکوپی و مولکولی با رویکرد آموزشی [1]
مدل الکترون نقطه ای و ساختار لوئیس [1]
پاورپوینت ماده و ساختار آن [1]
اصل آفبا و آرایش الکترونی اتمها [3]
پیوند قطبی [1]
پاورپوینت انتروپی [1]
پاورپوینت خواص کولیگاتیو [1]
دانلود کتابهای شیمی تکمیلی دبیرستان و راهنمایی سمپاد [1]
شناسایی متانول از اتانول [1]
قواعد فاجانس [1]
پاورپوینت کمک آموزشی “کاتیون های سنگین” [1]
نانوکاتالیست [1]
راکتورهای با نوترون سریع، راکتورهای زاینده [1]
بررسي اثر روش ساخت بر عملكرد كاتاليست گوگردزدايي [1]
بررسي سينتيكي و مقايسه فعاليت كاتاليستهاي هيدروتريتينگ در فرايند گوگرد زدايي تيوفن در گازوئيل [1]
سوالات کنکور کاردانی صنایع شیمیایی 91 [1]
محلول سازی در ازمایشگاه [2]
آموش PFD و P&ID [2]
برگه اطلاعات ایمنی اپوکسی رزین مایع [1]
ﭘﻮﺷﺶ اﭘﻮﻛﺴﻲ ﻛﻮﻟﺘﺎر CO-214 [1]
طرح توجيهی رزين الكيد [1]
روغن های روانکار صنعتی [1]
پیش فرض دانلود مقاله خوردگی و انواع آن [1]
Equine Wound Management Second Edition, 2009 [1]
Anatomy of the Horse [1]
Equine Massage: A Practical Guide [1]
Breeding Horses [1]
Fertility and Obstetrics in the Horse [1]
تحقيق خوردگي ميكروبيولوژي و نحوه كنترل آن [1]
پروژه متالوگرافي [1]
اثرات تداخلي روي در جذب و انتقال آهن [1]
بررسي اثر ضد انگلي گياه درمنه بر روي انگل پارابرونما اسكريابيني [1]
نظریه برخورد [1]
ويژگيهاي آب [1]
تحقیق هوای آلوده چیست [1]
مواد شيميايى كه مى خوريم [1]
تحقیق منگنز [1]
منابع انرژی تجدید پذیر [1]
منابع آبهاي زيرزميني در جهان [1]
معرفی رشته شیمی [2]
ماگماتيسم و سنگ هاي آذرين [1]
تحقیق ماده منفجره [1]
تحقیق لیپیدها [1]
لایه ی اوزون چیست [1]
کربوهیدرات [1]
طيف سنج جرمي [1]
تحقیق طلا [1]
تحقیق شیمی شیشه [1]
تحقیق شیمی تجزیه [1]
تحقیق شیمی آلی [1]
سینتیک شیمیایی [1]
دی اکسید کربن محلول ، PH ، قلیائیت ، سختی [1]
چربی [1]
ثابت تعادل شیمیایی [1]
امواج اولتراسوند فراصوت [1]
انبساط غير عادي آب [1]
تجزیه کیفی مواد آلی به روش ذوب قلیایی جهت تشخیص ازت [1]
تاریخ علم شیمی [1]
پیوند شیمیایی و انواع آن [1]
پلاستیک ها [1]
پرتو کاتدی [1]
مهندسی شیمی گاز [1]
بیوشیمی [1]
بمب شیمیایی [1]
انرژي خورشيدي [1]
کتاب آموزش انواع کمپروسور ها [1]
طول عمر شیمیست ها [1]
دانلود جزوه انتقال حرارت دانشگاه صنعتی شریف [1]
دانلود حل المسایل کتاب انتقال حرارت [1]
جزوه تئوری الاستیسیته و پلاستیسیته [1]
حل المسایل ترمودینامیک سنجل [1]
دانلود جداول ترمودینامیک [1]
روش های جداسازی [1]
شناسایی کاتبون های گروه اول [1]
پروژه روشهای انتقال گاز [1]
دانلود پایان نامه GTL [1]
گزارش کارآموزی شرکت گاز [1]
پروژه کلرزنی [1]
شرح فرآیند واحد FCC [1]
آشنایی با رشته صنایع شیمیایی [1]
بررسي راكتور بستر ثابت پيوسته [1]
ارزیابی سینیتیکی تبدیل متانول به الفین های سبک [1]
متفرقه
اسامی دختران ایرانی با نام الف با معنی و مفهوم آنها [1]
ارتباط وقايع [1]
طنز هیدروژنی [1]
نمونه سؤالات مسابقات هنرستانهاي فني و حرفه اي و کاردانش [1]
تغییرات کتاب های درسی در چاپ 1390 [0]
نام عمومی برخی از ترکیبات شیمیایی [1]
دروغ های علمی [1]
داستان کوتاه و جالب پند حکیمانه لقمان به پسرش [1]
دشت لاله های واژگون [1]
دانلود کتابهای درسی شیمی (نظری و فنی حرفهای) [1]
تو نیکی کن و در دجله انداز که ایزد در بیابانت دهد باز [1]
نامه ای از ویکتور هوگو [0]
تست هوش جدید [1]
زندگی خوابگاهی پسران دانشجو !! (آخر خنده) [1]
از شيمي آموختم [1]
قلب انسان اینطوری میزنه [0]
آموزش تولید تخم مرغ بدون خانم مرغ ها!!!!!!! [2]
پاسخ جالب یک دانشجو به سوال امتحان شیمی! [1]
واقعیت هایی شگفت انگیز درمورد انسان [3]
اشعار مدح و مرثيه حضرت زهرا (س) [1]
دانلود 13 کلیپ صوتی پیرامون [1]
عجیـب ترین رستـورانـهای جـهان [1]
۱۵ راهکار ساده برای غلبه بر افسردگی و غم [1]
ساخت بینی مصنوعی از پلیمر [1]
گاف های خیابانی در یک بازی [1]
آشنای دور [1]
فیلمهای آموزشی
فیلم ساخت سولفوریک [1]
فیلم تهیه نیترات آمونیوم [0]
فیلم ساخت اسید هیدرو کلریک ( HCl ) [1]
فیلم آموزشی سنجش حجمی اسید و باز [1]
فیلم آموزشی برخورد موثر [1]
فیلم آموزشی کاتالیزگر جذب سطحی [1]
فیلم آموزشی واکنش دهنده محدودکننده [1]
فیلم آموزشی افزایش آنتروپی [1]
فیلم آموزشی الکترولیت و غیرالکترولیت [1]
فیلم آموزشی انحلال نمک طعام در آب [1]
فیلم آموزشی سزیم کلرید [1]
فیلم آموزشی مولکول متان [1]
فیلم آموزشی مولکول کربن دی اکسید [1]
فیلم آموزشی مولکول آمونیاک [1]
فیلم آموزشی ساختار الماس [1]
فیلم واکنش پتاسیم و سدیم با آب [1]
فیلم تهیه گاز کلر از سدیم هیپوکلرایت [1]
دانلود «آشنای محبوب»؛ اولین فیلم آموزش روابط جنسی در ایران [2]
آموزش ویدئویی درس معادلات دیفرانسیل [1]
فیلم های آموزشی نرم افزار SAP2000 [1]
فیلم های آزمایشگاه مکانیک سیّالات [1]
قانون هس و محاسبه آنتالپی واکنش [2]
دانلود سخنرانی استاد رحیم پور با موضوع "به چه کسانی رای ندهیم؟ [0]
فیلم سخت زایی در گاو [1]
فیلم نمره بدنی در گوسفند و بز [1]
فیلم تکنیک اسپرم گیری [1]
فیلم آموزشی تلقیح مصنوعی در مرغ [1]
فیلم آموزشی اخته کردن [1]
فیلم آموزشی نوک چینی در طیور [1]
فیلم های آموزشی سالن های شیردوشی [1]
فیلم آموزش تلقیح مصنوعی در گاو همراه با [1]
فیلم آموزشی ایمنی در برق [1]
تولید مواد شیمیایی
واکس [1]
تهیه صابون در آزمایشگاه [1]
تهیه ژل مو [2]
زرد کروم و نارنجی کروم [1]
تهیه اتیلن و بررسی خواص آن ، تهیه استیلن و بررسی خواص آن ، یک روش شناسایی آلدهید ها [1]
تولید گاز متان ( تهیه گاز متان ) [1]
روش تهیه تولوئن [1]
تولید استن [1]
چگونه انواع گازها را در آزمایشگاه تولید کنیم؟ [1]
معرفی جامع عناصر جدول تناوبی
هیدروژن (H2) [1]
هلیم(He) [0]
ليتيم ( Li ) [1]
سدیم ( Na) [1]
پتاسیم ( K ) [1]
روبیدیم ( Rb ) [2]
سزیم ( Cs ) [2]
فرانسيم ( Francium ) [1]
بریلیم ( Be ) [1]
منیزیم ( Magnesium ) [1]
کلسیم ( Calcium ) [1]
استرانسیم ( Strontium ) [1]
باریم ( Barium ) [1]
راديم ( Radium ) [1]
اسکاندیم ( Scandium ) [1]
ایتریم ( Yttrium ) [1]
لانتانیم ( Lanthinum ) [1]
منیزیم ( Magnesium ) [0]
اکتینیم ( Actinium ) [1]
تیتانیم (Titanium) [2]
مدل لباس
مدل لباس مجلسی [16]
مدل کت و پالتو [6]
مدل لباس مجلسی – لباس هندی [2]
مدل لباس مجلسی کوتاه [2]
مدل بلوز [1]
مدل کاپشن [1]
مدل سارافون [1]
مهندسی کشاورزی
بیماری های گیاهان جالیزی و زینتی [7]
جدول احتياجات گاو وگوساله [1]
تكنولوژي مواد خوراكي [1]
استفاده از فضولات درتغذيه نشخوار كنندگان [0]
جداول احتياجات جوجه هاي گوشتي [1]
فساد ميكربي شير، گوشت و ماهي و بهداشت مواد غذايي [1]
محدودیت های مواد خوراکی دام [1]
مدیریتVAF [1]
کنه های خرما و انجیر [1]
بررسي اثر ضد انگلي گياه درمنه بر روي انگل پارابرونما اسكريابيني [1]
جزوه درس محاسبات عددی [1]
رشته سرامیک
مهندسی برق
جزوه درسی مبانی 1 و 2 [1]
آموزش تبدیلات مبنا [1]
حل المسائل کتاب مبانی احتمال شلدون راس [1]
آشنایی با پست های کمپکت [1]
بررسی ساختار و کاربرد رله های حفاظتی در شبکه های برق [1]
بررسی و تحلیل ترانسفورماتورهای قدرت [1]
بررسي دستگاهها و ادوات الکتریکی كارخانه سيمان [1]
مدلسازی بار [1]
فیبر نوری [1]
تولیدات پراکنده DG [1]
آشنایی با پست های فوق توزیع GIS [1]
سيستمهاي حفاظت صاعقه(برقگير) [1]
پایان نامه مدیریت بار [1]
گزارش کارآموزی - شرکت توزیع نیروی برق [1]
نیروگاه سیکل ترکیبی [1]
جزوه رله و حفاظت الکتریکی [1]
ايده عجيب براي كاهش مصرف برق در سوئد [1]
هندبوک توسعه و احداث شبکه های توزیع برق [1]
استانداردهای صنعت برق ایران [1]
آشنایی با پست های كمپكت [1]
آرشیو کامل سال 2003 و 2004 مجله SERVO [1]
نرم افزار آموزشی کیفیت توان Install Power Quality Teaching Toy [1]
کاربرد نرم افزار Digsilent Power Factory [1]
مجموعه کتاب های سیم کشی و عیب یابی آنها [1]
آشنایی با المان های الکترونیک قدرت [1]
شناخت تجهیزات شبکه های توزیع نیروی برق و مسائل مرتبط با آن [1]
جزوه ترانسفورماتورهای قدرت [1]
فایل اتوکد طراحی سیستم اعلام حریق یک کارخانه صنعتی [1]
کامپیوتر
آموزش تبدیلات مبنا [1]
حل المسائل کتاب مبانی احتمال شلدون راس [1]
آموزش مهارتهای هفت گانه ICDL [1]
نرم افزار کاربردی کامپیوتر [13]
مهندسی صنایع
مجموعه لغات تخصصی مهندسی صنایع [1]
خلاصه دروس مهندسی صنایع مؤسسه پارسه [1]
حل المسائل کتاب مبانی احتمال شلدون راس [1]
اندروید
فیلم ایرانی
دانلود فیلم پاشنه بلند [1]
دانلود فیلم آخرین سرقت [1]
دانلود فیلم بی خود و بی جهت [1]
دانلود فیلم زندگی با چشمان بسته [1]
دانلود فیلم برگشت ناپذیر [1]
دانلود فیلم کبری ۰۰۱۲ [1]
دانلود فیلم آسانسور [1]
دانلود فیلم شوکران [1]
دانلود فیلم آبی [1]
دانلود فیلم نطفه شوم [1]




 زعفران گلخانه ای
زعفران گلخانه ای تولید اب نوشیدنی خنک دربیابان!!!
تولید اب نوشیدنی خنک دربیابان!!! نرم افزار متخصصین علوم شیمی محاسباتی Gaussian 09W v7.0 + GaussView v5.08 + Nanotube Modeler v1.6.4
نرم افزار متخصصین علوم شیمی محاسباتی Gaussian 09W v7.0 + GaussView v5.08 + Nanotube Modeler v1.6.4