جزوه کنترل فرآیندها در مهندسی شیمی (دانشگاه آزاد تهران جنوب)
دوستان لطفا نظر و حمایت یادتون نره
مرسیییی
پسورد : www.ejozve.ir

جزوه کنترل فرآیندها در مهندسی شیمی (دانشگاه آزاد تهران جنوب)
دوستان لطفا نظر و حمایت یادتون نره
مرسیییی
پسورد : www.ejozve.ir
لانتانیدها عنصرهای 58 تا 71جدول تناوبی را تشکیل میدهند و جزو عناصر واسطه داخلی میباشند. وجه تسمیه لانتانیدها از عنصر 57 جدول یعنی لانتان (La) گرفته شده است. باید توجه داشت که خواص شیمیایی این دسته از عناصر مشابه خواص لانتان میباشد همچنین به این گروه از عناصر ، عناصر خاکهای کمیاب "Rare-earth elements"نیز اطلاق میشود. در واقع اطلاق نام خاکهای نادر یا کمیاب ، از آنجائیکه این عناصر نه کمیابند و نه به آن دسته از اکسیدهای خاکی مانند (اکسیدهای) آلومینا، زیرکونیا و ایتریا تعلق دارند، غلط مصطلح است. زمانیکه نخستین اعضای این گروه برای اولین بار کشف شد، بصورت اکسید مجتمع گردیده بودند و از آنجائیکه این اکسیدها تا اندازهای به اکسیدهای کلسیم ، منیزیم و آلومینیوم که بعدها به آنها عنوان اکسیدهای خاکی اطلاق گردید، شباهت دارند، لذا این عناصر به نام خاکهای کمیاب معروف گردیدند. در هر صورت باید توجه داشت که سریم در پوسته زمین بسیار فراوان تر از سرب بوده و نیز ایتریم از قلع بسیار فراوانتر است و حتی باید اذعان نمود که کمیاب ترین خاکهای کمیاب ، به استثنای پرومتیم ، بسیار از عناصر گروه پلاتین فراوانترند.
اگرچه لانتانیدها بصورت بسیار گسترده در طبیعت پخش میباشند، لکن بطور کلی در غلظتهای کم یافت میشوند. همچنین در برخی از مواد کانی بصورت مخلوط و در غلظتهای زیاد ملاحظه شده اند. جدول زیر نمایانگر برخی از کانیهای معروف لانتانیدها میباشد.
|
ماده کانی
|
شکل بلور
|
ترکیب فرمولی
|
| مونازیت (monazite) |
تک شیب
|
CePO4 با Th3(PO4)4
|
| زنوتیم (xenotime) |
چهارگوش
|
YPO4
|
| گادولینیت (gadolinite) |
تک شیب
|
2BeO.FeO.Y2O3.2SiO2
|
| بستناسیت (bastnasite) |
ششگوش
|
CeFCO3
|
| سامارسکیت (samarskite) |
مکعب مستطیل
|
Ca٫Fe٫UO2)3O.Y2O3.3(Nb٫Ta)2O5)
|
| فرگوزونیت (fergusonite) |
چهارگوش
|
Y2O3.3(Nb٫Ta)2O5
|
| اوکسنیت (euxenite) |
مکعب مستطیل
|
Y2(NbO3)3.Y2(TiO3)3.1½H2O
|
| ایتروفلوئوریت (yttrofluorite) |
مکعب
|
2YF3.3CaF3
|
مهمترین کانیهای خاکهای کمیاب عبارتند از:مونازیت ، زنوتیم ، بستناسیت.
معمولا این مواد بوسیله اعمال مکانیکی مانند شناورسازی و یا استفاده از
روشهای مغناطیسی تغلیظ میشوند. سپس لانتانیدها در حالتیکه بصورت کانیهای
فسفات یا سیلیکات میباشند، بوسیله اسید مورد شستشو قرار میگیرند. برخی از
کانیها مانند کولومبوتانتالاتها با کربن حرارت داده شده و یا تحت تاثیر
کاستیک قوی قبل از سنگ شویی قرار داده میشوند.
لانتانیدهای مخلوط شده را میتوان از محلولهای اسیدی با استفاده از رسوب اگزالات جدا کرد. اشتعال اگزالات باعث تولید اکسیدهای لانتانیدهای مخلوط خواهد گردید. سپس این اکسیدها غالبا با استفاده از روشهای تبادل یونی و استفاده از خیساندن در اسید تغلیظ میشوند. در این حال لانتانیدها در محلول بصورت یونهای سه ظرفیتی هیدراته که دارای خواص بسیار مشابه میباشند، درمیآیند. بنابراین آنها تمایل به تشکیل رسوبهای بلوری مخلوط یا محلولهای جامد نشان میدهند. استفاده از یک ماده شیمیایی واحد به منظور افزایش غلظت یکی از عناصر خاکهای کمیاب لزوم تکرار عملیات را ایجاب مینماید. یکی از روشهایی که در گذشته و حال مورد استفاده بوده و هست، استفاده از فرایندهای جزء به جزء مانند تبلور جزء به جزء و یا تجزیه جزء به جزء به منظور خالص کردن عناصر می باشد. در این شرایط ، مقدار کار بسیار زیاد به منظور جداکردن مقدار بسیار کمی از عناصر ، باعث بالارفتن هزینه های خلوص خاکهای کمیاب و برشمردن آنها بدین صنعت خواهد بود. اکنون نیز از روشهای جزء به جزء هنوز در زمینه جداسازی این خاکها در حالت خام و بویژه عناصر لانتان و سریم استفاده میشود، زیرا سریم را می توان از لانتان با استفاده از حالت چهار ظرفیتی سریم جدا کرد. در حال حاضر سایر اعضای خانواده خاکهای کمیاب را با استفاده از فرآیندهایی تبادل یونی خالص می نمایند مضافا چنانچه درجه خلوص بالا مدنظر نباشد، می توان از روش استخراج مایع- مایع بدین منظور استفاده کرد.
لانتانیدها فلزهایی براق هستند و واکنش پذیری شیمیایی قابل توجهی دارند. خواص شیمیایی این دسته از عناصر مشابه خواص لانتان با عدد اتمی 57 می باشد. کلیه این عناصر قادر به تشکیل املاح سه ظرفیتی می باشند و زمانیکه این املاح در آب حل می شوند، خواص شیمیایی بسیار مشابه از خود نشان می دهند. لانتانیدها ، نظر به وضعیت جدو!ل تناوبی، بدین صورت هستند که همچنانکه عدد اتمی آنها افزوده می شود، بار افزوده شده روی هسته آنها بوسیله پر شدن لایه های ناقص داخلی آنها با الکترونها ، موازنه میشود. ولی به هر حال باید توجه داشت که این لایه ها نقشی در نیروهای والانس ما بین اتمها ایفا نمی نمایند. لانتانیدها به علت برخوردار بودن از خواص اختصاصی دارای پتانسیل باارزشی در زمینه استفاده بعنوان عوامل آلیاژی میباشند. این عناصر با استفاده از احیاء گرمایی بوسیله اثر کلسیم ، لیتیم و یا سایر فلزات قلیایی برهالید بی آب آنها و سپس ذوب مجدد در خلا به منظور تبخیر نشانه های باقیمانده از مواد احیا کننده، احیا می شوند. همچنین میتوان آنها را بصورت الکترولیتی از حمامهای ملح ذوب شده مانند آنچه در زمینه سریم و میش متال (مخلوط فلزات خاکهای کمیاب ، اساسا سریع با مقدار بسیار کمی از آهن) صورت می پذیرد، احیا کرد. باید توجه داشت که مواد جامد بدون آب همچنین نشان دهنده تغییر زیادتری در خواص ما بین عناصر نسبت به املاح هیدراته هستند. خاکهای کمیاب با بعضی از ترکیبات آلی ، املاح آلی تشکیل میدهد. این کیلیت ها که در اطراف این یونها ، آب جایگزین می نمایند، باعث زیاد شدن تغییر در خواص ما بین هر یک از خاکهای کمیاب میشوند. سودمندی این تکنیک در روشهای جدید تبادل یونی ، در زمینه جداسازی این عناصر کاملا قابل ملاحظه است.
آنالیز های ساختاری
پراش اشعه ی ایکس
پديده پراش پرتو X
پراش
پرتوX كه توسط مجموعه اتمها پديد ميآيد ناشي از تقويت پرتو پراكنده شده
در جهتهاي ويژه قضايي است پس از برخورد پرتو X به الكترونهاي ماده آنها
را به نوسان وادار ميكند و اين الكترونها نيز باعث تابش پرتو X درفضاي
اطراف خود با همان بسامد پرتو ابتدايي خواهند شد.اگر پرتوهاي پراكنده با
هم جمع شوند موج برآيند پديد ميآيد كه دامنه آن بستگي به تعداد
الكترونها و اختلاف فاز موجهاي تابيده خواهند داشت. اختلاف فاز پديد
آمده بستگي به اختلاف مسير پيموده شده توسط پرتوها دارد پرتو پديد آمده
توسط اتمهاي گوناگون نيز با يكديگر و به دليل اختلاف مسير پيموده شده
اختلاف فاز پيدا خواهند كرد و اين اختلاف فاز باعث تغيير دامنه پرتو
تابيده از مجموعه اتم خواهد شد. از آنجا كه شدت يك پرتو متناسب با توان
دوم دامنه آن است تغييرات موجود در فاصلههاي پيموده شده توسط پرتوها سبب
تغيير دامنه آنها ميشود. بنابراين در حالتهاي ويژهاي كه دامنه پرتوها
با هم جمع شوند پرتو تابيده از مجموعه اتمها تقويت ميشود و به آن پراش
گويند. براي درك اين نكته بايد توجه كرد
كه پرتوهاي پراكنده شده از يك مجموعه اتمي در بيشتر حالتها به خاطر
موجود نبودن فاصله مناسب و به دنبال آن جمع نشدن دامنهها يكديگر را تضعيف
ميكنند و شدت پرتو نهايي بسيار ناچيز خواهد بود. دو پرتو با طور موج را در نظر بگيريد كه با يكديگر هم فاز هستند. پس از پيمودن مسافت مشخص

براساس آنچه بيشتر توضيح داده شد تمام پرتوهايي كه به صفحه اول اتمي برخورد ميكنند پس از بازتاب به دليل اينكه
مسافت پيموده شده آنها يكسان است ميتوانند يكديگر را تقويت كنند پرتو
بازتابيده از لايه دوم مسافت بيشتري را ميپيمايد. اگر اين اختلاف فاصله
مضربي از باشد دو پرتو يكديگر را تقويت خواهند كرد. حال اگر مسافت پيموده شده توسط پرتو بازتابيده از لايه دوم به اندازه
جهت و شدت پرتو X
براساس رابطه قبل طول موج پرتو X يعني ثابت است و در آزمايش XRD زاويههايي كه پراش در آنها صورت ميگيرد (يعني
اجزاي دستگاه پراش پرتو X
در دستگاه پراش پرتو X از يك لوله پديدآورنده پرتو بر روي نمونه مجهول
ميتابد و شدت پرتو پراشيده در زاويههاي گوناگون اندازهگيري ميشود بدين
ترتيب وظيفه دستگاه پراش، تعيين زاويههايي است كه طبق رابطه براگ پديده
پراش در آنها صورت ميگيرد. همچنين شدت اين پرتوها نيز اندازهگيري ميشود
مطابق شكل زیر دستگاه پراش از يك دايره فلزي به نام دايره پراش تشكيل شده
است كه لوله پديد آورنده پرتو X و آشكارساز بر روي محيط آن و نمونه مجهول
در مركز آن قرار دارند.



مطابق
اين شكل، نمونه مجهول در مركز دايره و بر روي يك سكوي قابل چرخش قرار
ميگيرد اين سكو ميتواند نمونه را به دو محور عمود بر صفحه كاغذ در برابر
پرتو بچرخاند بنابراين نمونه مجهول زاويههاي گوناگوني نسبت به پرتو اختيار
ميكند. توليد پرتو X به صورت ثابت و در همسايگي محيط دايره پراش به
گونهاي قرار ميگيرد كه نقطه كانوني خروج پرتو X از آن بر روي محيط واقع
شود پرتو X كه تولید می شود به صورت واگرا و پس از عبور از دريچه با زاويه به نمونه مجهول برخورد ميكند و پرتو پراشيده به صورت همگرا با زاويه

آزمايش پراش سنجي را در گستره ده تا هفتاد درجه انجام ميدهند ولي گاهي ميتوان گستره
را از صفر تا 160 درجه نيز انتخاب كرد. از آنجا كه شدت پرتو پراشيده به
تدريج ثبت ميشود و شدت جريان و همچنين ولتاژ لوله پديد آورنده پرتو X بر
مقدار شدت پرتو اثر دارند بايد دستگاه پراش سنجي داراي قسمت يكنواختساز
ولتاژ و جريان باشد.
ترانسفورماتور تامين كننده ولتاژ بالا قسمتهاي الكتريكي مربوط به
كنترلهاي گوناگون و همچنين قسمت گردش آب را نيز بايد از ديگر اجزاي جانبي
دستگاه پراش دانست. در آزمايش پراش سنجي پرتو X به حدود يك سانتيمتر مربع
از سطح نمونه مجهول ميتابد. طبيعي است كه نمونه مجهول بايد به طول كامل
صاف باشد چند گرم از نمونه مجهول پودري شكل را با قرار دادن در داخل
جانمونهاي ويژه و صاف كردن سطح آن ميتوان آزمايش كرد بهتراست كه پودر را
تا زير 10 ميكرومتر نرم نمود و به هنگام قرار دادن آن در جانمونهاي از
فشردن بيش از حد كه باعث آرايش ترجيحي فازها گردد دوري كرد. نمونههاي فلزي
را به طور مستقيم و به شكل صفحه صاف در جانمونهاي قرار ميدهند.
شناسايي مواد به كمك پراش پرتو X
الگوي پرتو X هر تركيب منحصر به فرد است در آزمايش پراش سنجي هدف اصلي
تعيين زاويههاي مربوط به هر پيك و سپس مشخص كردن فاصله صفحههاي اتمي
(مقدار d) ميباشد. با در دست داشتن ارقام مربوط به d كه با دست كم سه رقم
پس از اعشار آرايه ميشود ميتوان با مراجعه به جدولهاي مربوط ماده مجهول
را شناسايي كرد. بنابراين نخستين گام پس از به دست آوردن الگوي پراش پرتو
X تهيه جدولي است كه در آن

اين
كارتها PDF(Powder diffraction file) يا JCPD(Joint committee for
powder diffraction) ناميده ميشوند. مهمترين اطلاعات ارقام مربوط به سه
پيك قوي در الگوست كه در سمت بالا و چپ كارت مشخص شدهاند.
اگر اين d ها با اطلاعات تعيين شده در آزمايش مورد نظر همخواني داشته باشد
ميتوان بقيه dها را براي قضاوت نهايي مقايسه كرد اما اگر اين dها با
اطلاعات به دست آمده از پراش سنجي همخواني نداشته باشد بايد كارت تركيب
ديگري را بررسي كرد. در عمل لازم نيست براي مقايسه ابتدايي از كارتهاي
پراش سنجي استفاده كرد براي سرعت عمل بيشتر بايد ابتدا از جدولهاي موجود
در كتابهاي پراش سنجي استفاده شود. اين جدولها برحسب حروف الفبا تنظيم
شده و هشت d مربوط به هر تركيب را ميتوان به سرعت پيدا كرد. علاوه بر
ارقام مربوط به d اطلاعات مربوط به شدتهاي نسبي نيز به صورت انديس همراه
با اين ارقام آورده شده است.
روش تعيين فاز به كمك پراش سنجي يك روش صحيح و خطاست. به اين ترتيب كه پس
از تعيين dها و شدتهاي نسبي پس از آزمايش پراش سنجي بايد آنها را با dها و
شدتهاي يك تركيب حدسي مقايسه كرد. به همين ترتيب به روش حدس و مقايسه
ميتوان فازهاي مربوط را مشخص نمود. اگر نمونه مجهول داراي فازها يا
تركيبهاي زياد (به عنوان مثال بيش از 5 فاز يا تركيب) باشد به علت تداخل
پيكهاي مربوط به فازها شناسايي فازي با اطمينان بالا همراه نخواهد بود به
ويژه براي فازهايي كه مقدار آنها در نمونه مجهول كم است (كمتر از 10 درصد
وزني) اين مشكل در مقايسه با dهاي اندازهگيري شده با آنچه در كارت
استاندار وجود دارد نمود بيشتري خواهد داشت. از جمله عوامل موثر بر مقدار d
درجه تبلور و حضور ناخالصيهاست. آنچه در كارتهاي استاندارد به عنوان d
آرايه ميشود به نمونههاي تهيه شده در شرايط آرماني تعلق داشته و بنابراين
نميتوان همخواني كاملي را با dهاي اندازهگيري شده توسط پراش سنجي
انتظار داشت تهيه اين نمونهها با مواد اوليه خالص حرارت دادن طولاني در
شرايط كنترل شده و تعادلي بوده است. بنابراين تبلور و تشكيل ساختار
كاملتري را بايد براي آنها انتظار داشت تاكنون بحث اصلي در شناسايي مواد
به روش XRD براساس مقدار d استوار بوده و به شدت پيك اشاره نشده است. از
شدتهاي نسبي پيكها ميتوان وقتي كه همخواني dها رضايتبخش نبوده و يا
شناسايي تركيبها ساده نيست استفاده كرد. در اين گونه موارد مقايسه
شدتهاي ثبت شده در الگوي پرتو X با آنچه در كارت پيشبيني شده است
ميتواند كمك بزرگي باشد به ويژه زماني كه يكي از سه پيك اصلي يك فاز بر
روي يك پيك از فاز ديگر افتاده باشد قضاوت با اطمينان در مورد حضور آن فاز
مشكل خواهد بود. در چنين حالتي متفاوت بودن شدت آن پيك با آنچه در كارت
استاندارد پيشبيني شده راهنماي مناسبي براي تاييد فاز مورد نظر ميباشد
در مواردي كه نمونه به طور كامل ناشناخته است چون در عمل مشخص نيست كه
dهاي الگوي اندازهگيري شده را بايد با چه كارتي مقايسه كرد تشخيص فازهاي
موجود در نمونه كار مشكلي خواهد بود.
گرچه اين نوع شناسايي به ندرت پيش ميآيد در بيشتر مواقع با اطلاعات جانبي
كه از نمونه مجهول در دست است امكان مقايسه فراهم ميشود. در اين حالت نيز
يك روش مقايسهاي وجود دارد به اين معني كه با مراجعه به كتابهاي
ويژهاي كه در آن مقدار d مواد بسياري با سير كاهشي و افزايشي نشان داده
شدهاند امكانپذير ميباشد. اگر نمونه مجهول فقط يك فاز داشته باشد
تعيين آن به اين روش آسان است ولي در صورتي كه داراي بيش از 3 فاز باشد
شناسايي آن بسيار مشكل خواهد بود علت اين است كه رديف جدولها در اين
كتابها برحسب dهاي يك تركيب تنظيم شده و زماني كه تعداد فازها زياد باشد
به راحتي نميتوان سه d مربوط به يك فاز را از مجموعه dها انتخاب كرد.
بديهي است براي درك دقيق روشهاي شرح داده شده حضور در آزمايشگاه XRD و
انجام چند مورد آزمون شناسايي فازي ضروري است. امروزه استفاده از
نرمافزارهاي كامپيوتري فرايند مقايسه dها و شناسايي فازي را سرعت
بخشيدهاند.بيشتر دستگاهها به قسمت جستجو مجهربوده و بنابراين با وارد
كردن dهاي اندازهگيري شده نوع فازها را ميتوان مشخص كرد.البته نتيجهاي
كه از اين نرمافزارها به دست ميآيد همراه با خطاست. نكته اول آنكه با
خطاي جزيي كه در اندازهگيري dوجود دارد با توجه به اينكه دستگاه ارقام
وارد شده به عنوان d را با هزاران ماده مقايسه ميكند امكان اشتباه زياد
است و گاه مشاهده ميشود كه فاز مورد نظر را بسيار اشتباه پيشنهاد ميكند.
دوم آنكه زماني كه نمونه مجهول داراي چند فاز است چون دستگاه قادر به
تفكيك dهاي مربوط به هر فاز نيست در تشخيص تركيبهاي موجود علاوه بر
فازهاي واقعي، تركيبهاي ديگري را نيز پيشنهاد خواهد كرد. به اين ترتيب
استفاده از نرمافزارهاي جستجوي كامپيوتري مفيدند ولي بايد با احتياط
انجام شود.
كاربردهاي جانبي روش XRD
اگر چه كاربرد اصلي روش XRD شناسايي فازي و كاني مواد و تعيين ساختار بلوري
ماده است ولي در علم مواد اين روش كاربردهاي ديگري هم دارد كه به برخي از
آنها اشاره خواهد شد.
تعيين اندازه ذرات
در روش پراش سنجي پهن شده پك يك ماده به كاهش اندازه ذرات آن وابسته بوده
كه به رابطه شرر معروف است. بنابراين ميتوان اندازه ذرات يك ماده را با
اين روش مشخص كرد رابطه شرر به صورت زير است:
تعيين
ثابت شبكه در علم مواد اهميت زيادي دارد به عنوان مثال ميتوان با
اندازهگيري آن درباره حلاليت يك ماده در ساختار بلورين تركيب ديگر قضاوت
كرد. همچنين با اندازهگيري ثابت شبكه در دماهاي گوناگون ميتوان ضريب
انبساط حرارتي ماده را تعيين نمود. از آنجا كه در هر ساختار بلورين فاصله
بين صفحههاي بلوري d و ثابت شبكه a روابط مشخصي وجود دارد با اندازهگيري
دقيق d مقدار a تعيين خواهد شد. شايد گمان شود كه چون در كار پراش سنجي
مقدار d را ميتوان تعيين كرد پس مقدار a هم قابل تعيين است. واقعيت اين
است كه در كار روزانه شناسايي فازي و تعيين مقدارهاي مربوط به d كه از روي زاويههاي
مربوط به دست ميآيند اين كار با دقت خيلي بالا كه براي تعيين ثابت شبكه مورد نظر است انجام نميشود.
بنابراين وقتي در كار پراش سنجي هدف اندازهگيري مقدار a است مشكل اصلي تعيين دقيق مقدار
اندازهگيري تنش باقيمانده در نمونه
به كمك روش XRD ميتوان تنش باقيمانده را در يك ماده بررسي كرد. اساس اين روش تغيير فاصله صفحههاي بلورين ماده به دليل وجود تنش است كه باعث جابجايي محل پيكها ميشود. اگر در ماده بدون تنش فاصله صفحههاي بلورين باشد. موقعيت پيك در زاويه
آناليز كمي
از آنجا كه شدت پيك در الگوي پراش پرتو X متناسب با مقدار فازهاي
موجود در نمونه است ميتوان به كمك اين روش آناليز كمي نيز انجام داد. به
عبارت ديگر نه تنها ميتوان نوع فازها را مشخص كرد بلكه امكان تعيين مقدار
آنها نيز وجود دارد. ولي با توجه به مشكلات زياد و تقريبي بودن آن كمتر از
روش XRD استفاده ميشود. بديهي است كه شدت پيكها كه شدت پرتو پراشيده را
نشان ميدهند علاوه بر مقدار فاز به عوامل ديگري نيز وابسته است. شدت
پرتو ابتدايي توسط شدت جريان لوله پديد آورنده پرتو X و ولتاژ اعمالي
تعيين ميشود بنابراين بايد به آنها توجه كرد از طرف ديگر اندازه ذرات نوع
فازهاي موجود در زمينه حساسيت آشكارساز و همچنين سرعت چرخش نمونه همگي بر
ارتفاع پيك اثر دارند. بنابراين بايد با ساخت نمونههاي ويژه و يا
استفاده از مواد استاندارد اين اثرات را تصحيح نمود. چند روش براي آناليز
كمي به كمك پراش سنجي مرسوم است كه معروفترين آنها ساخت استاندارد داخلي
است و علاقهمندان براي مطالعه بيشتر بايد به مراجع تخصصي موجود در اين
زمينه مراجعه كنند.
در ادامه ی معرفی روش پراش پرتوی ایکس به صورت شناسنامه ای ، این روش مورد ارائه قرار می گیرد.
تعيين ثابت شبكه

در پراش اشعه ی ایکس ، یک پرتوی موازی از اشعه ی ایکس ، با طول موج نیم تا 2
آنگستروم ، روی یک نمونه برخورد کرده و با فازهای بلوری در نمونه با توجه
به قانون براگ ، پراشیده می شود. شدت اشعه ی ایکس به صورت تابعی از زاویه
ی پراش یعنی زاویه و جهت گیری
نمونه ، اندازه گیری می شود. این الگوی پراش برای تعیین فازهای بلوری
نمونه و اندازه گیری خواص ساختاری آن شامل کرنش (که با دقت زیاد)
همبافتگی(Epitaxy) و اندازه و جهت گیری کریستالایت ها(منطقه های بلوری
کوچک) استفاده می شود. XRD همچنین پروفایل های غلظتی ، ضخامت لایه ها ،
آرایش اتم ها در مواد آمورف و چندلایه را می توان تعیین نماید. همچنین قادر
به مشخصه یابی عیوب نیز هست . برای بدست آوردن این اطلاعات فیزیکی و
ساختاری از لایه های نازک ، تجهیزات XRD و روش هایی طراحی شده اند که شدت
اشعه های ایکس پراشیده را ماکسیمم می کند ، زیرا توان پراش لایه های نازک
کوچک است.
محدوده ی عناصر قابل آنالیز : تمام عناصر ، اما نه عنصری خاص . عناصر با عدد اتمی کوچک به سختی آشکار سازی می شوند
آشکارسازی عمقی : معمولا تا چند میکرومتر ، ولی وابسته به ماده است
محدودیت های آشکارسازی : وابسته به ماده ، اما تقریبا در مواد دو فازی 3 %
مخرب بودن آزمون : خیر ، برای اکثر مواد
پروفایل برداری عمقی : معمولا خیر ، اما قابل دستیابی است
لازمه های نمونه : هر ماده ای ، با ابعاد بیشتر از نیم سانتی متر
قدرت تفکیک عرضی : معمولا خیر
استفاده های اصلی :
تعیین فازهای بلوری ، تعیین کرنش و جهت گیری و اندازه گیری کریستالایت ها ، تعیین دقیق آرایش های اتمی
استفاده های خاص : تصویر برداری و مشخصه یابی از عیوب ، آرایش های اتمی در
مواد آمورف و چند لایه ، پروفایل های غلظتی با عمق ، اندازه گیری های
ضخامت
طيف سنجي فوتوالكترون پرتو اکس (XPS)
در
اين روش سطح نمونه توسط پرتو X بمباران شده و انرژي الكترونها (يا
فوتوالكترونهاي) خروجي از نمونه اندازهگيري ميشود(مطابق شكل زیر).

اگر
پرتو X ابتدايي كه به سطح نمونه برخورد ميكند انرژي كافي داشته باشد سبب
خروج الكترون از مدارهاي داخلي (به عنوان مثال مدار K) خواهد شد. اگر
انرژي جنبشي الكترون خروجي با EK و انرژي پيوند الكترون در مدار مربوط با
Eb نشان داده شود رابطه ساده زير به دست ميآيد كه در آن hν انرژي پرتو X
ابتدايي است:
Ek=hν-Eb
پرتو X ابتدايي را به طور معمول MgKα و يا AlKα انتخاب ميكنند كه در هر
حال انرژي مشخصي دارد. آنچه در دستگاه اندازهگيري ميشود مقدار Ek است و
بنابراين طبق رابطه بالا Eb را ميتوان تعيين كرد. چون Eb براي هر اتم
مقدار معيني است با تعيين آن ميتوان نوع اتم را شناسايي كرد به عبارت ديگر
با اندازهگيري Eb آناليز عنصري سطح نمونه انجام خواهد شد. با وجود اينكه
پرتو X ابتدايي در عمق 5000 آنگسترومي نفوذ ميكند ولي فوتوالكترونهاي
پديد آمده فقط از 50 آنگسترومي سطح نمونه بخت خروج از سطح را پيدا ميكنند.
همانطور كه پيشتر اشاره شد فوتوالكترونهاي پديد آمده در عمق بيشتر به
خاطر بر هم كنش با اتمهاي نمونه از بين ميروند و نميتوانند خود را به
سطح برسانند در روش XPS تعيين انرژي جنبشي الكترون خروجي (Ek )اصليترين
كميت مورد اندازهگيري است. اين اندازهگيري در يك دستگاه به نام طيف سنج
الكتروني انجام ميگيرد.
اساس كار طيف سنجي الكتروني، تفكيك انرژي الكترونها در يك ميدان الكتريكي است.
در شكل زیر شيوه كار و اجزاي اصلي دستگاه طيف سنج الكتروني نمايش داده شده است.


در
روش XPS پرتو X پس از خروج از لوله پديد آورنده پرتو به كمك يك بلور
پراشيده و به صورت تك موج به سطح نمونه مجهول ميتابد. در اثر برخورد پرتو X
به اتمهاي نمونه الكترون مدارهاي داخلي كنده شده و به داخل طيف سنج
الكتروني هدايت ميشوند. پرتو X به سطحي حدود يك سانتيمتر مربع بر روي
نمونه برخورد كرده و با توجه به اينكه فقط برانگيختگي لايههاي اتمي مورد
نظر هستند مقدار نمونه لازم در حد mg1/0 خواهد بود. محل قرار گرفتن نمونه
مجهول در نزديكي ورودي طيف سنج الكتروني است و الكترونهاي خروجي از سطح در
ابتداي ورود به طيف سنج در اثر اعمال ميدان الكتريكي به درون نيم كره
الكترواستاتيكي جمع ميشوند. هدف از اين كار جمع كرن فضايي الكترونهاي با
انرژي گوناگون در نقاط ورودي بخش نيم كره يا تفكيك كننده انرژي است.
الكترونهاي خروجي از نمونه و در پي آن الكترونهاي جمع شده در قسمت ورودي
دستگاه تفكيك كننده داراي انرژيهاي جنبشي گوناگون بوده و بايد پيش از
آنكه به آشكارساز الكتروني هدايت شوند از نظر مقدار انرژي تفكيك گردند در
بخش نيم كره طيف سنج الكتروني با اعمال ميدان الكترواستاتيكي و تغيير شدت
آن ميتوان به الكترون برحسب مقدار انرژي جنبشي ابتدايي كه دارد امكان
رسيدن به آشكارساز را فراهم كرد.
به عبارت سادهتر، الكترونهاي ورودي به نيم كره كه داراي انرژيهاي
گوناگوني هستند در يك ميدان كه به صورت مثبت در سطح پاييني نيم كره و به
صورت منفي در سطح بالايي آن اعمال ميشود امكان نجات و رسيدن به آشكارساز
را بدون برخورد به ديواره نيم كره پيدا ميكنند.
بنابراين مقدار انرژي هر الكترون در طيف سنج الكتروني براساس شدت ميدان
الكترواستاتيكي اعمال شده براي گذر از مسير نيم كره محاسبه ميشود.
آشكارساز در انتهاي نيم كره قرار دارد و شدت يا جمعيت الكترونها را تعيين
ميكند.
با توجه به توضيحي كه در مورد طيفسنج الكتروني داده شد الگو يا طيفي را كه
قسمت ثبت كننده دستگاه رسم ميكند تغيير شدت برحسب انرژي جنبشي خواهد بود
كه در آن پيكهاي مربوط به حضور الكترونهايي كه انرژي ويژه دارند ديده
ميشود. نمونهاي از اين طيف در مورد سطح تمیز یک قطعه ی مسی در شكل زیر
مشاهده می شود.

در
روش XPS همانطور كه اشاره شد آناليز شيميايي به كمك طيفسنجي الكتروني
انجام ميگيرد و به همين دليل اين روش به نام طيف سنجي الكتروني براي
آناليز شيميايي ESCA نيز شناخته شده است.
اثر جابجايي شيميايي
اثر جابجايي شيميايي نخستين بار توسط سيگبال در اوايل دهه 60 ميلادي كشف شد.
طبق اين پديده انرژي پيوند الكترون مدارهاي داخلي يك اتم بستگي به محيط
شيميايي اطراف آن يا به عبارت ديگر بستگي به پيوند اتمي آن دارد. براي درك
بهتر اين پديده به طيف XPS تركيب پلي متيل متا كريلات كه در شكل 4-8 نشان
داده شده است توجه كنيد.

اثر جابجايي شيميايي اطلاعاتي را از محيط شيميايي اطراف اتم آشكار ميكند كه بسيار مفيد است. در واقع توانايي اصلي روش ESCA يا XPS بيشتر از آنكه در آناليز سطح باشد در تعيين محيط شيميايي عنصرهاي موجود در نمونه است. مقدار جابجايي شيميايي در مواد گوناگون متفاوت است و ميتواند از 15-5/0 الكترون ولت تغيير كند. در دستگاه XPS امكان بمباران سطح نمونه و لايهبرداري به كمك تاباندن پرتوي از يونهاي يك گاز مثل آرگون وجود دارد. در اين حالت با لايهبرداري از سطح آناليز در عمق نمونه انجامپذير خواهد شد و تغيير تركيب شيميايي از سطح به عمق را ميتوان بررسي كرد. تشكيل تركيبهاي گوناگون بر سطح مواد به صورت يك لايه نازك به كمك روش XPS به آساني قابل بررسي ميباشد در حالي كه با روشهاي ديگر اين كار امكانپذير نيست.
در ادامه به صورتی مختصر پارامترهای اصلی XPS اشاره می شود.
در طیف نگاری فوتوالکترون ها بوسیله ی اشعه ی ایکس (XPS) ، اشعه ی ایکس تک
انرژی و نرم نمونه ی مورد نظر را بمباران کرده و منجر می شود الکترون ها
از ماده فرار کنند. تعیین عناصر حاضر در نمونه مستقیما از انرژی های
سینتیک این فوتوالکترون های به خارج پریده ، امکان پذیر است. در مقیاسی
کوچک تر همچنین می توان حالت شیمیایی عناصر حاضر را از انحرافات مختصر در
انرژی های سینتیکی تعیین شده ، مشخص کرد. غلظت های نسبی عناصر از روی شدت
های فوتوالکترون های جذب شده مشخص می گردد. برای یک جامد ، و بسته به ماده
، انرژی فوتوالکترون و زاویه ی اندازه گیری(نسبت به سطح) ، XPS از 2 تا
20 لایه ی اتمی را به عمق رفته و پویش می کند. توانایی های ویژه ی XPS در
آنالیزهای عنصری نیمه کمی روی سطح بدون استانداردها و آنالیز حالت های
شیمیایی ، برای مواد مختلف از مواد بیولوژیکی تا متالورژیکی ، بیان می شود.
XPS همچنین تحت عنوان طیف نگاری الکترونی برای آنالیز های شیمیایی (ESCA)
نیز شناخته می شود.
محدوده ی عناصری که آنالیز می شوند : تمام عناصر بجز هیدروژن و هلیم
مخرب بودن آزمون : خیر ، بعضی تابش ها مواد حساس به اشعه ی ایکس را تخریب می کنند
آنالیز عنصری : بله ، نیمه کمی بدون استاندارد ها – کمی با استاندارد ها – روشی برای آنالیز عناصر جزئی در نمونه نیست
اطلاعات راجع به حالت شیمیایی : بله
عمقی که آنالیز می شود : 5 تا 50 آنگستروم
پروفایل برداری از عمق نمونه : بله ، تا 50 آنگستروم ، عمق های بیشتر نیاز به فرآیند پروفایل برداری کندوپاشی دارد
قدرت تفکیک عمقی : از چند تا چندین ده آنگستروم ، بسته به شرایط
قدرت تفکیک عرضی : 5 میلی متر تا 75 میکرومتر ، کمتر از 5 میکرومتر در بعضی دستگاه ها
لازمه های نمونه : تمام مواد سازگار با خلا ، نمونه های تخت بهترین هستند ، اندازه بسته به دستگاه مورد استفاده مشخص می شود
استفاده های اصلی : تعیین عناصر و حالات شیمیایی ترکیبات در بالای 30 آنگسترومی نمونه

طيفسنجي الكترون اوژه (AES)
روش اوژه روش ديگري براي مطالعه سطح بوده كه در آن چشمه ابتدايي بمباران، به جاي پرتو X پرتو الكترون است. اساس اين روش در شكل زیر مشاهده ميشود.

با
تابش پرتو الكتروني به سطح نمونه مجهول الكترونهاي معروف به الكترون
اوژه از سطح نمونه خارج شده و با اندازهگيري انرژي جنبشي آنها ميتوان
نوع عنصر را در سطح تعيين كرد. بايد توجه نمود كه پس از خروج الكترون (به
عنوان مثال از مدار K) جايگزيني الكترون از مدار بالاتر (به عنوان مثال L)
امكانپذير ميگردد. براي آنكه اتم به حالت الكتروني پايدار ابتدايي
برگردد بايد انرژي برانگيختگي خود را يا به طريق تابش فوتون (پديده XPS) و
يا با انتقال اين انرژي به الكترون ديگر از دست بدهد. اگر حالت اول پديد
آيد پرتو X مشخصه اتم پديد ميآيد و اگر حالت دوم صورت پذيرد الكترون خروجي
را الكترون اوژه و اين پديده را نيز پديده اوژه مينامند.
مطابق رابطهاي كه براي روش XPS توضيح داده شد با توجه به شكل بالا ميتوان رابطه زير را نيز براي پديده اوژه نوشت:
EAuger=EK-EL2-EL3
EAuger انرژي جنبشي الكترونهاي اوژه خروجي EL2 ، EK و EL3 انرژي مدارهاي اتمي هستند.
در رابطه بالا EL2 و EK انرژي ابتدايي پديد آمده در اتم است كه بايد يا به
پرتو تبديل شود و يا صرف كندن الكترون مدار نزديك به خود (به عنوان مثال
EL3) بشود. به عبارت ديگر مقداري از اين انرژي صرف غلبه بر پيوند الكترون
در مدار خود (يعني EL3) و مقداري صرف پديد آمدن انرژي جنبشي در آن الكترون
ميشود. حال اگر بتوان مقدار EAuger را اندازهگيري كرد مقدار EK-EL2-EL3
به دست ميآيد و از آنجا كه اين مقدار براي هر اتم معين است ميتواند
مشخصه آن اتم باشد. در حقيقت با تعيين انرژي جنبشي الكترونهاي اوژه خروجي
از سطح نمونه ميتوان نوع اتم موجود در سطح را تعيين كرد و يا به عبارت
ديگر آناليز عنصري سطحي را انجام داد. در اين پديده به هنگام خالي شدن
اربيتال K ممكن است انتقال الكتروني از مدارهاي ديگر غير از مدار L نيز
پديد آيد و همچنين خروج الكترون اوژه از مدار ديگر غير از آنچه در مثال
بالا اشاره شد صورت پذيرد. بنابراين در پديده اوژه براي يك اتم انتقالهاي
گوناگوني وجود دارد و به هر حال در هر انتقال دست كم 3 مدار اتمي درگير
هستند. براساس آنچه كه در مثال بالا به آن اشاره شد اين انتقال KLL ناميده
ميشود. نكته جالب در پديده اوژه وابسته نبودن انرژي الكترونهاي اوژه به
انرژي چشمه ابتدايي برانگيختگي است. اين نكته در مقايسه با پديده XPS كه
در آن انرژي فوتوالكترونها تابع مقدار انرژي ابتدايي چشمه برانگيختگي بود
قابل توجه است. به هنگام برانگيختگي يك اتم، پديدههاي گوناگوني مانند
پديده اوژه و XRF در كنار هم و در رقابت با يكديگر صورت ميگيرد و به
عبارت ديگر، برحسب عدد اتمي و محيط شيميايي اتم موجود در نمونه درصدي از
اتمها با پديده اوژه و درصد ديگري با پديد آمدن پرتو مشخصه (XPS) پس از
برانگيختگي به حالت پايدار اتمي ميرسند. با كاهش عدد اتمي بخت پديده اوژه
بيشتر از پديده XRF ميشود در حالي كه در اتمهاي سنگين پديده XRF حاكم
بوده و الكترونهاي اوژه بسيار ناچيزند.اين نكته از ديدگاه آناليز شيميايي
عنصرهاي سبك به كمك روش XRF همواره با مشكلات زيادي همراه است و قابل
توجه ميباشد. به زبان ساده، روش اوژه براي آناليز اتمهاي سبك موثر بوده و
ميتواند به جاي روش XRF به خدمت گرفته شود. اجزاي دستگاه اوژه مانند
اجزاي دستگاه XPS است. در يك محفظه بدون هوا (با فشار 10-5- 10-10 torr)
نمونه مجهول توسط پرتو الكتروني بمباران شده و الكترونهاي اوژه پديد آمده
به داخل يك تفكيك كننده الكترواستاتيكي مانند آنچه در روش XPS توضيح داده
شد هدايت ميشوند. تفكيك كننده الكترونها را براساس انرژي جنبشي كه
دارند جدا ميكند و شدت پرتو الكتروني توسط يك آشكارساز الكتروني
اندازهگيري ميشود. (مطابق شکل زیر)

محفظه نگهدارنده نمونه علاوه بر تفنگ الكتروني مجهز به بمباران كننده يوني نيز ميباشد تا بتوان به اين وسيله لايه برداري از سطح نمونه و آناليز در عمق را نيز انجام داد. آنچه در دستگاه اوژه به عنوان طيف اوژه رسم خواهد شد در شكل زیر ديده ميشود. (برای قطعه ی فولادی که سطح آن غیرفعال شده)
از آنجا كه جمعيت الكترونهاي اوژه كم بوده و شدت پرتو ناچيز است با رسم مشتق شدت پيكهاي قويتري به دست خواهد آمد.
همانطور كه اشاره شد در روش اوژه از بمباران الكتروني استفاده ميشود
بنابراين آناليز سطح در اين روش در مقايسه با روش XPS محدود به چند لايه
سطحي است. به عبارت ديگر در محدوده حداكثر 20 آنگسترومي سطح خواهد بود. از
طرف ديگر در روش اوژه از الكترون به عنوان چشمه برانگيختگي استفاده
ميشود. بنابراين ميتوان با ايجاد پديده روبش مانند آنچه در روش
ميكروسكوپ الكتروني روبشي SEM به كار ميرود از سطح نمونه تصويربرداري
كرد.اين روش ميكروسكوپ روبشي اوژه SAM ناميده ميشود.
تهیه صابون در آزمایشگاه
بررسی واکنشهای تهیه صابون با استفاده از چربیها و بررسی خواص چربیها

روندهای صابون سازی ، عملاً از 2000 سال است که بدون تغییر باقی مانده است . روش عمل ؛ هیدرولیز قلیایی ( صابونی شدن ) چربی است . از نظر شیمیایی ، معمولاً چربیها همان تری گلیسریدها هستند . روند صابونی شدن شامل حرارت دادن چربی با محلول قلیایی است . اصولاً در گذشته این محلول قلیایی از طریق شست و شوی خاکستر چوب ، یا از تبخیر آبهای قلیایی که در طبیعت یافت می شوند به دست می آمد . امروزه قلیاب صابون پزی ( سدیم هیدروکسید ) به عنوان منبع قلیا به کار می رود . محلول قلیایی ، چربی را به اجزاء تشکیل دهنده ؛ نمک اسید کربوکسیلیک با زنجیر طویل ( صابون ) و الکل ( گلیسرول ) هیدرولیز می کند . وقتی نمک معمولی اضافه می شود صابون رسوب می کند . برای خارج کردن سدیم هیدروکسید اضافی و سدیم هیدروکسیدی که وارد عمل نشده است ، آن را شسته و ذوب کرده و قالب گیری می کنند .
عمل صابون در پاک کنندگی :
مولکول صابون دارای سر قطبی است ، که در آب حل می شود ( نمک کربوکسیلات ) و دارای دم طویل هیدروکربنی است که در روغن محلول است . دم هیدروکربنی صابون در ماده روغنی حل می شود و سر یونی خود را در خارج از سطح روغن نگاه می دارد و به همین دلیل ، توانایی انحلال و تمیز کردن چربی و کثافات را دارد .

تهیه صابون :
در این آزمایش از چربی حیوانی صابون تهیه خواهیم کرد . چربیهای حیوانی و روغنهای گیاهی استرهای ، اسیدهای کربوکسیلیک با وزن مولکولی زیاد و گلیسرول است . از نظر شیمیایی ، این چربیها و روغنها را تری گلیسریدها می نامند .
رایجترین چربیها و روغنهایی که در تهیه صابون مصرف می شوند ، چربیهای حیوانی و پیه آب کرده از منابع حیوانی و نخل و نارگیل و روغن زیتون از منابع گیاهی هستند . معمولاً صابون سازها پیه آب کرده را با روغن نارگیل مخلوط می کنند و عمل صابونی کردن را روی این مخلوط انجام می دهند .
صابون حاصل در اصل ، شامل نمک اسیدهای پالمتیک ، استئاریک و اولئیک به دست آمده از پیه و نمک لوریک اسید و نمک میریستیک حاصل از روغن نارگیل به منظور تهیه صابون نرمتر و محلولتر اضافه می شود .
در شکل زیر ساختار ؛ استئاریک اسید ، پالمتیک اسید ، و اولئیک اسید حاصل از پیه و میریستیک اسید و لوریک اسید حاصل از روغن نارگیل را مشاهده می کنید :

چربیهای معمولی در واکنشهای ویژه استرها شرکت می کنند ، واکنش مهم و کاربردی چربیها ، هیدرولیز قلیایی آنهاست . محصول این هیدرولیز ، نمک اسیدهای چرب است که به عنوان صابون مورد استفاده قرار می گیرند . این واکنش مهم را صابونی شدن می گویند .
در شکل زیر واکنش صابونی شدن را مشاهده می کنید :

در شکل زیرمکانیسم واکنش صابونی شدن یا مکانیسم واکنش هیدرولیز قلیایی استرها را مشاهده می کنید :

برای تهیه صابون هر چربی یا روغن گیاهی را می توان مورد استفاده قرار داد ، اما چربی جامد بهتر است .
روش کار تهیه صابون :
10 گرم از یک روغن یا چربی را در یک بالن 250 میلی لیتری بریزید و به آن محلول سود که از حل کردن 10 گرم سود یا پتاس در داخل 36 میلی لیتر محلول 50 درصد ، آب و اتانول 95 درصد حاصل شده است ، اضافه نمائید . با استفاده از یک مبرد عمودی مخلوط را حدود 30 دقیقه روی چراغ گاز با شعله ملایم رفلاکس یا بازروانی کنید . پایان واکنش وقتی است که در محلول روغن مشاهده نشود . سپس الکل را تقطیر کنید و مقطر حاصل را به ظرف مخصوصی منتقل نمائید و به مسئول آزمایشگاه تحویل دهید . باقیمانده ؛ صابون ، گلیسرین و مقداری قلیا و الکل است . اکنون 50 گرم سدیم کلرید را در 150 میلی لیتر آب حل نموده و آن را سرد کنید و مخلوط حاصل از واکنش را به سرعت در آن بریزید و مخلوط را برای چند دقیقه به هم بزنید و سپس در حمام یخ قرار دهید . مخلوط باید به دمای معمولی برسد . پس از مدتی صابون جدا می شود . صابون را به وسیله صاف کردن از محلول جدا نمائید و دو بار با آب سرد بشویید و در معرض هوا قرار دهید تا خشک شود .
در تهیه صابون به طریق صنعتی ، گلیسرول را به عنوان یک محصول جانبی با ارزش جدا می کنند
گاز
کلر، به عنوان یکی از هالوژن ها دارای الکترونگاتیوی بالایی است و در
طبیعت به صورت عنصر و گاز یافت نمی شود و تنها ترکیبات آن در طبیعت وجود
دارد. ویدیویی برای تهیه این گاز از سدیم هیپوکلرایت برای دانلود قرار داده
شده است. این گاز بسیار سمی، کشنده و خورنده است و برای این آزمایش باید
اطلاعات بیشتری بدست بیاورید.
در سایر مقالات مهندسی شیمی انیمیشن و مقالاتی نیز در مورد کلر و تهیه آن وجود دارد که با جستجو می توانید آنها را نیز مشاهده کنید.

نظرات (0)
تاریخ : پنجشنبه 31 فروردین 1391 زمان : 12:15
بازدید : 816
نویسنده : کلاغ سفید
واکنش
بین پتاسیم و آب و عموماً فلزات قلیایی یکی از جالب ترین واکنش ها و
همچنین دارای اهمیت درسی در دوره دبیرستان است. در این قسمت یک نسخه ویدیو (
فیلم ) برای دیدن این واکنش برای دانلود قرار داده شده که میتواند جالب
باشد.
فلزات قلیایی، گروه اول سمت چپ که شامل سدیم، پتاسیم و ... را شامل می گردد.


برای بدست آوردن اکسید آهن خالص، به وسایل زیر احتیاج دارید:
- منبع تغزیه بالای 12 ولت ( آداپتور بهترین گزینه )
- افزایش دهنده رسانایی آب ( نمک طعام یا سدیم هیدروکسید که سود سوز آور نیز نامیده می شود )
- یک الکترود ذغالی ( می توانید از مغز باتری استفاده کنید )
- آهن خالص
ابتدا یک ظرف پلاستیکی که نیازی به آن ندارید را تهیه کنید ( تمیز باشد ). ظرف شما حتماً پلاستیکی باشد چرا که در هنگام برقکافت ممکن است واکنش های مشابهی ایجاد گردد و فرآورده اکسید آهن نباشد.
این ظرف را پر آب کنید. میزان نمک زیاد نباشد. ( سیر نشود )
در این ظرف مقداری نمک یا سدیم هیدروکسید حل کرده تا رسانایی آب افزایش یابد. سپس قطب منفی منبع تغزیه خود را به الکترود ذغالی زده، قطب مثبت را به آهن متصل کنید. آب سطح آهن و الکترود را بپوشاند.
سپس منبع تغزیه را فعال کنید. دقت داشته باشید جریان DC بوده و الکترود با آهن در آب تماس نداشته باشد. (احتمال انفجار منبع تغزیه )
حال 24 ساعت صبر کنید تا واکنش انجام شود. هرگاه به اندازه کافی اکسید در سطل جمع شد، می توانید جریان را قطع کنید. آهن های باقی مانده را دور ریخته، محلول آب و اکسید آهن را از صافی عبور دهید تا تکه پاره های آهن جدا شده، سپس محلول را بجوشانید تا آب آن بخار شده، اکسید آهن خالص در ظرف بماند.
نکته: الکترود ذغالی هیدروژن آزاد می کند. بهتر است از جرقه دور بماند و کار را در محیط باز انجام دهید.
نکته: آب ظرف را هنگام واکنش به هم نزنید؛ چرا که اطراف قطب ها اسیدی و بازی می شوند و واکنش را تخریب می کنید.
یک انیمیشن بسیار کامل در زمینه گرمای تعادل و انتقال گرما و سرعت آن بین آب و چند فلز و نافلز. این انیمیشن با نوشتن گرمای ویژه مواد و نمودار های کامل از سرعت انتقال گرما، راهنمای بسیار کاملی در این زمینه می باشد.

ویژگی های ظاهری
منیزیم ( magnesium ) در گروه دوم جدول تناوبی با عدد اتمی 12 جای دارد. فلز نقره ای رنگ، نسبت به حجم بسیار سبک و خاصیت کششی بسیار بالایی دارد، به طوری که بریدن 10 سانت از آن شاید یک ربع طول بکشد. به همین دلیل در ساختن بدنه هواپیما کاربرد فراوانی دارد. همچنین در صنایع آتش بازی از این فلز بهره برداری می شود.
خواص شیمیایی
این فلز به راحتی با اکسیژن واکنش داده، در هنگام سوختن شعله خیره کننده ای از نور سفید مانند درخشش ستاره ایجاد می کند. مشاهده این نور برای چشم بسیار مضر است. اکسید منیزیم به عنوان ماده دیر گداز در ساخت کوره های صنعتی استفاده می گردد. دمای سوختن منیزیم به قدری بالاست که می تواند ماده ترمیت ( ترمایت، Thermite ) را روشن کند.
عدد اکسایش منیزیم +2 می باشد. پس می توان واکنش های زیر را برای این فلز در نظر گرفت:
2Mg + O2 => 2MgO اکسید منیزیم
Mg + Cl2 => MgCl2 کلرید منیزیم
استخراج منیزیم و اشکال طبیعی
منیزیم به صورت کلرید منیزیم MgCl2، دولومیت کلسینه شده MgCO3.CaCO3 و همچنین در آب دریا وجود دارد.
برای استخراج منیزیم از آب دریا، این یون را بوسیله آب آهک به صورت منیزیم هیدروکسید رسوب می دهند. سپس آن را در هیدروکلریک اسید حل می کنند. از تغلیظ محلول آخیر، نمک منیزیم به فرمول MgCl2.6H2O متبلور می شود. از الکترولیز مذاب این نمک در دمای 700 درجه سلسیوس منیزیم در کاتد و گاز کلر در آند بدست می آید.
روش دیگر استخراج منیزیم، روش دولومیت کلسینه شده با آلیاژ آهن و سلسیم در درمای 1150 سلسیوس می باشد.
خواص فیزیکی
نقطه ذوب: 922 درجه کلوین ( 649 درجه سلسیوس )
نقطه جوش: 1363 درجه کلوین ( 1090 درجه سلسیوس )
چگالی : 1.74 g/cm3
انیمیشن فلش درباره سلول الکترولیز آب نمک برای بدست آوردن گاز کلر و سدیم هیدروکسید. این انیمیشن با استفاده از آند گرافیتی و کاتد جیوه ای استفاده می شود.
این انیمیشن با فرمت swf ( فلش ) بوده و نیاز به فلش پلیر ( Flash Player ) دارد.
اصطلاح فولاد برای آلیاژهای آهن که تا حدود 1.5% کربن دارند و غالباً با فلزهای دیگر همراهند، بکار می رود. خواص فولاد به دصد کربن درآن، عملیات حرارتی انجام شده بر روی آن و فلزهای آلیاژ دهنده موجود در آن بستگی دارد. از فولادی که تا 0.2% کربن دارد، برای ساختن سیم، لوله و ورق فولاد استفاده می شود. فولاد متوسط که 0.2 تا 0.6 درصد کربن دارد آن را برای ساختن ریل، دیگ بخار و قطعات ساختمانی به کار می برند. فولادی که 0.6 تا 1.5 درصد کربن دارد سخت است و از آن برای ساختن ابزارآلات، فنر و کارد و چنگال استفاده می گردد.
آهنی که از کوره بلند خارج می شود ( چدن ) دارای مقادیر کمی کربن، گوگرد، فسفر، سیلیسیم، منگنز و ناخالصی های دیگر است. این ناخالصی ها سبب شکنندگی آهن شده، آن را برای مصارف بی فایده می سازد. در تولید فولاد دو هدف دنبال می شود: یکی سوزاندن ناخالصی های چدن و دیگری افزودن مقادیر معین از مواد آلیاژ دهنده به آهن است.
فسفر، سیلیسیم، منگنز در چدن مذاب توسط هوا یا اکسیژن به اکسید تبدیل می شوند و با کمک ذوب مناسبی ترکیب شده، به صورت سرباره خارج می شوند. گوگرد به صورت سولفید وارد سرباره می شود و کربن هم می سوزد و به صورت منوکسید یا کربن دی اکسید در می آید. چنانچه ناخالصی اصلی منگنز باشد، یک کمک ذوب اسیدی – معمولاً سیلیسیم دی اکسید – به کار می برند.
MnO + SiO2 => MnSiO3 (l)
و چنانچه ناخالصی اصلی سیلیسیم یا فسفر باشد ( و معمولاً نیز چنین است ) یک کمک ذوب بازی – که معمولاً منیزیم اکسید یا کلسیم اکسید است – اضافه می کنند.
MgO + SiO2 => MgSiO3 (l)
6MgO + P4O10 => 2Mg3(PO4)2 (l)
معمولاً جدار داخلی کوره ای را که برای تولید فولاد به کار می زود، توسط آجرهایی که از ماده کمک ذوب ساخته شده اند، می پوشانند. این پوشش مقداری از اکسیدهایی را که باید خارج شوند، به خود جذب می کند. برای جدا کردن ناخالصیها، معمولاً از روش کوره باز استفاده می کنند. این کوره یک ظرف بشقاب مانند دارد که در آن 100 تا 200 تن آهن مذاب جای می گیرد. بالای این ظرف یک سقف مقعر قرار دارد که گرما را روی سطح مذاب منعکس می کند. جریان شدیدی از اکسیژن را از روی فلز مذاب عبور می دهند تا ناخالصی های موجود در آن بسوزند. در این روش، ناخالصی ها در اثر انتقال گرما در مایع و عمل پخش به سطح مایع می آیند و عمل تصفیه چند ساعت طول می کشد، البته مقداری از آهن اکسید می شود که آن را جمع آوری کرده، به کوره بلند باز می گردانند.
در روش دیگری که از همین اصول شیمیایی برای جدا کردن ناخالصی ها از آهن استفاده می شود، آهن مذاب را همراه آهن قراضه و کمک ذوب در کوره ای بشکه مانند که گنجایش 300 تن بار را دارد می ریزند. جریان شدیدی از اکسیژن خالص را با سرعت مافوق صوت بر سطح فلز مذاب هدایت می کنند و با کج کردن و چرخانیدن بشکه، همواره سطح تازه ای از فلز مذاب را در معرض اکسیژن قرار می دهند. اکسایش ناخالصی ها بسیار سریع صورت می گیرد و وقتی محصولات گازی، مانند CO2 رها می شوند، توده مذاب را به هم می زنند، به طوری که آهن ته ظرف رو می آید. دمای توده مذاب آهن بی آنکه از گرمای خارجی استفاده شود، به نقطه جوش آهن می رسد و در چنین دمایی، واکنش ها فوقالعاده سریع بوده، تمامی این فرآیند در یک ساعت یا کمتر کامل می شود و محصولی یکنواخت با کیفیت خوب بدست می آید.
آهن مذاب تصفیه شده را با افزودن مقدار معین کربن و فلزهای آلیاژ دهنده مانند وانادیم، کروم، تیتانیم، منگنز و نیکل به فولاد تبدیل می کنند. فولادهای ویژه ممکن است مولبیدن، تنگستن یا فلزهای دیگر داشته باشند. این نوع فولادها برای مصارف خاصی مورد استفاده قرار می گیرند.
در دمای زیاد، آهن و کربن با یکدیگر متحد شده، کاربید آهن به نام سمانتیت، Fe3C، تشکیل می دهند. این واکنش برگشت پذیر و گرما گیر است.
3Fe + C <=> Fe3C
هر گاه فولادی که دارای سمانتیت است به کندی سرد شود، تعادل فوق به سمت تشکلیل آهن و کربن جا به جا شده، کربن به صورت پولک های گرافیت جدا می شود و به فلز، رنگ خاکستری می دهد. بر عکس اگر فولاد به سرعت سرد شود، کربن عمدتاً به شکل سمانتیت که رنگ روشنی دارد باقی می ماند. تجزیه سمانتیت در دمای معمولی به اندازه ای کند است که عملاً انجام نمی گیرد. فولادی که دارای سمانتیت است از فولادی که دارای گرافیت است سخت تر و شکننده تر است. در هر یک از این دو نوع فولاد، مقدار کربن را می توان در محدوده نسبتاً وسیعی تنظیم کرد. همچنین، می توان مقدار کل کربن را در قسمت های مختلف یک قطعه فولاد تغییر داد و خواص آن را بهتر کرد. مثلاً بلبرینگ از فولاد متوسط ساخته شده تا سختی و استحکام داشته باشد، لیکن سطح آن را در بستری از کربن حرارت می دهد تا لایه نازکی از سمانتیت روی آن ایجاد شود و بر سختی آن افزوده گردد.
بررسی شیمیایی اکسیژن
اکسیژن گازی است بی رنگ، بی بو و بی طعم و دارای دما جوش بسیار ناچیز ( -183 درجه سانتی گراد ) و در حالت مایع به رنگ آبی روشن می باشد. اکسیژن به میزان ناچیز در آب حل می شود. یک لیتر آب در دمای 20 °C و فشار یک اتمسفر حدود 30 ml گاز اکسیژن را در خود حل می کند که همین میزان اندک نیز برای ادامه حیات آبزیان کافیست.
آرایش الکترونی اتم اکسیژن به صورت 1s12s22p6 است. اکسیژن از نظر خاصیت الکترونگاتیوی بعد از فلوئور قرار دارد؛ از این رو، در ترکیب با فلوئور عدد اکسایش مثبت خواهد داشت. به عنوان مثال در OF2 عدد اکسیژن عدد اکسایش +2 را دارد. اکسیژن با تمامی عنصرها به جز گازهای نجیب، هالوژن ها و بعضی از فلزها مانند نقره، طلا و پلاتین ترکیب می شود. اگرچه پیوند O - O در مولکول اکسیژن پایدار است؛ اما اکسیژن با بعضی از عوامل کاهنده قوی معدنی و با بسیاری از ترکیب های آلی خود به خود در دمای معمولی واکنش می دهد. زنگ زدن آهن و اکسایش بعضی از مواد آلی نیز واکنش با اکسیژن است که خود به خود انجام می گیرند، اما در دمای عادی کند هستند. برای واکنش موثر با اکسیژن به دمای زیاد و در مواردی نیز هم به فشار زیاد نیاز است.
تعدادی از واکنش های اکسیژن در زیر ذکر شده است:
C4H10 (l) + 13/2 O2 (g) => 4 CO2 (g) + 5H2O (g)
SiH4 + 2O2 (g) => SiO2 + 2H2O (g)
4Fe(s) + 3/2 O2 (g) + nH2O (l) => Fe2O3 . nH2O
S (s) + O2 (g) => SO2 (g)
P4 (s) + 5O2 (g) => P4O10 (s)
2Mg (s) + O2 (g) => 2MgO (s)
4Al + 3O2 (g) => 2Al2O3 (s)
ترکیب هر عنصر با اکسیژن یک واکنش اکسایش است. بر اثر واکنش هر ماده مرکب با اکسیژن غالباً محصولاتی بدست می آید که در آن ها هریک از عنصرهای سازنده ماده اصلی با اکسیژن ترکیب شده اند؛ مثلا واکنش آمونیاک و سولفید کربن با اکسیژن را در نظر بگیرید:
4NH3 (g) + 5O2 (g) => 4NO (g) + 6H2O (g)
CS2 (g) + 3O2 (g) => CO2 (g) + 2SO2 (g)
ملاحظه می شود که در واکنش آمونیاک با اکسیژن، هم نیتروژن و هم هیدروژن با اکسیژن ترکیب شده اند و مولکول های NO و آب را به وجود آورده اند. در مورد واکنش سولفید کربن با اکسیژن نیز محصولات واکنش حاصل ترکیب کربن با اکسیژن یعنی کربن دی اکسید و گوگرد با اکسیژن یعنی گوگرد دی اکسید است.
هر واکنش شیمیایی که با آزاد شدن گرما و نور همراه باشد، نظیر سوختن فلز منیزیم در اکسیژن اصطلاحاً احتراق نامیده می شود. از احتراق متان که جز اصلی گاز طبیعی است، مقدار قابل ملاحضه ای انرژی آزاد می شود:
CH4 (g) + 2O2 (g) => CO2 (g) + 2H2O (l) ΔH = -890 KJ
نتیجه کامل احتراق کامل ترکیب هایی که از کربن و هیدروژن یا از کربن، هیدروژن و اکسیژن ( مانند کربوهیدرات ها ) تشکیل شده اند، با مقدار کافی اکسیژن، منحصراً کربن دی اکسید و آب است، اما اگر مقدار اکسیژن کافی نباشد، کربن مونو اکسید ( مونوکسید ) و آب حاصل تشکیل می شود.
طرز تهیه اکسیژن
بیش از 90% اکسیژن در صنعت از راه تقطیر جز به جز هوای مایع به دست می آید. بیشترین مصرف اکسیژن در صنایع فولاد سازی است. در تبدیل چدن به فولاد اکسیژن را مستقیماً اثر می دهند تا احتراق ناخالصی ها سریعتر صورت گیرد. اکسیژن در تصفیه فاضلاب نیز مورد استفاده قرار می گیرد. برای تولید اکسیژن از الکترولیز نیز استفاده می شود [ در بخش شیمی » الکتروشیمی مقاله ای در این باب موجود است ]، اماً هزینه آن زیاد است. اکسیژن حاصل از این راه خالص است.
سیلیسیم و خالص سازی آن
ساختار بلور سیلیسیم، سیلیسیم کاربید SiC، و سیلیس SiO2 مانند الماس به صورت کوالانسی مشبک است. برای تجسم بلور سیلیس می توان چنین تصور کرد که در بلور سیلیسیم، میان هر پیوند Si -- Si یک اتم اکسیژن به صورت پل قرار گرفته است. سیلیسیم کاربید و سیلیسیم دیوکسید مانند الماس، سخت و شکننده اند و دمای ذوب زیادی دارند. این اجسام به علت داشتن جفت الکترون های مستقر در سراسر شبکه بلور رسانایی الکتریکی ندارند. کاربرد صنعتی الماس و سیلیسیم کاربید به سختی آن ها مربوط می شود.
سیلیسیم از حرارت دادن سیلیس و کک در دمایی حدود 3000 درجه سانتی گراد در کوره الکتریکی بدست می آورند.
SiO2 (s) + 2C (s) => Si(l) + 2CO (g)
برای تهیه سیلیسیم جهت مصرف صنایع الکترونیک، ابتدا سیلیسیم را توسط کلر به سیلیسیم تترا کلرید تبدیل می کنند:
Si(s) + 2Cl2 (g) => SiCl4 (l) نقطه جوش 57.6 درجه
سپس سیلیسیم تترا کلرید را در دمای زیر توسط منیزیم می کاهند:
SiCl4 (g) + 2Mg (s) => 2MgCl2 (s) + Si (s)
منیزیم کلرید را با شستن توسط آب از سیلیسم جدا می کنند. سپس سیلیسیم را به حالت مذاب در آورده، آن را به صورت میله منجمد می نمایند. آنگاه برای تهیه سیلیسیم بسیار خالص جهت صنایع الکترونیک از روش ذوب موضعی استفاده می شود. به طوری که میله سیلیسیم را در کوره مخصوص قرار می دهند و با حرکت دادن تدریجی گرم کن کوره، منطقه مذاب را در طول میله پیش می برند. با توجه به اینکه ناخالصی ها در شبکه بلور خالص جا نمی گیرند، به تدریج در منطقه مذاب وارد شده، سرانجام در انتهای میله جمع می شوند. آنچه مشاهده می شود شبیه پدیده نزول نقطه انجماد است. در نزول نقطه انجماد جسم حل شده در محلول باقی می ماند، درحالی که حلال خالص منجمد می شود.
در روش ذوب موضعی، منطقه مذاب محلولی از ناخالصیها ( جسم حل شده ) در سیلیسیم ( حلال ) است. در حالی که منطقه بعدی از جامد ناخالص در حال ذوب شدن است، مقداری از سیلیسیم در منطقه قبلی در حال انجماد می باشد. ناخالصی ها موجب نزول نقطه انجماد محلول باقیمانده می شوند که غلظت ناخالصی های در آن رو به افزایش است. این محلول را با ناخالصی های جدید آزاد شده از منظقه ذوب شده مخلوط شده، محلول غلیظتری را تشکیل می دهد. با ادامه این فرآیند در طول میله ناخالصی های قبلی جمع می شود و سرانجام به انتهای میله می رسند. پس از قطع این قسمت از میله، این فرآیند را چند بار تکرار می کنند. درجه خلوص سیلیسیم بدست آمده بیش از 99.999999% است.
نیتریک اسید و روش ساخت
نیتریک اسید خالص 100%، مایعی بی رنگ است که در دمای -42 درجه سانتی گراد ذوب و در دمای 83 درجه می جوشد. در صورتی که جوشش در نور انجام شود و محیط اتاق باشد، در دمای 72 درجع نیتریک اسید به صورت زیر تجزیه می شود:
4 HNO3 → 2 H2O + 4 NO2 + O2 (72°C)
اسید نیتریک ( HNO3 ) دارای چگالی 1.5 بوده و غیر اشتعال پذیر است. محلول 68% آن در دمای 120 درجه سانتی گراد می جوشد.
واکنش نیتریک با فلزات
واکنش مس با نیتریک اسید غلیظ باعث تولید آنیون مس می شود:
Cu + 4 H+ + 2 NO3− → Cu2+ + 2 NO2 + 2 H2O
اماً واکنش مس با محلول 100% آن به شکل زیر است:
3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
از تاثیر منیزیم بر نیتریک 100% نیترات منیزیم و گاز هیدروژن آزاد می شود:
Mg (s) + 2 HNO3 (aq) → Mg(NO3)2 (aq) + H2 (g)
واکنش نیتریک با نا فلزات
واکنش نیتریک اسید به جز گاز های نجیب، سلیکون و هالوژن ها باعث اکسید شدن با بیشترین عدد اکسایش ممکن می شود:
تهیه نیتریک اسید
روش استوالد:
از سوختن آمونیاک در مجاورت پلاتین نیتروژن اکسید به دست می آید:
4NH3(g) + 5O2 => 4NO (g) + 6H2O (g)
نیتروژن اکسید ( نیتریک اسید ( گازی بیرنگ است که به سرعت با مقدار اضافی اکسیژن واکنش داده، گاز خرمایی رنگ نیتروژن دی اکسید را به وجود می آورد:
2NO (g) + O2 (g) => 2NO2
از حل کردن نیتروژن دی اکسید در آب، نیتریک اسید و نیتروژن اکسید حاصل می شود:
3NO2 (g) + H2O (l) => HNO3 (aq) + NO (g)
استفاده از سولفوریک اسید:از حل کردن گاز نیتروژن تری اکسید ( نیترات ) در سولفوریک اسید بی سولفات جامد و نیتریک اسید گازی بدست می آید.
H2SO4 + NO3 → HSO4 (s) + HNO3 (g)
سولفوریک اسید خالص مایعی است گرانرو ( چگالی 1.85 g/cm3 ) که در دمایی حدود 10 درجه ذوب و در 290 درجه می جوشد و بر اثر تجزیه آن SO3 و آب تولید می شود.
H2SO4 => SO3 + H2O

سولفوریک اسید تجاری که در آزمایشگاه مصرف می شود، به طور تقریب 98 درصد وزنی اسید دارد و 18 مولار است. این اسید وقتی به آب اضافه گردد، گرمای زیادی تولید می کند، لذا باید هنگام اضافه کردن سولفوریک اسید به محلول آبی بسیار دقت کرد. به این منظور باید اسید را به آهستگی در آب ریخت و محلول را به هم زد.
سولفوریک اسید اسیدی قوی است و در محلول آبی در دو مرحله یونیده می شود:
H2SO4 (aq) ↔ H+ (aq) + HSO4- (aq)
HSO4- (aq) ↔ H+ (aq) + SO4 (aq)
در محلول رقیق، مرحله اول یونش تقریباً کامل است. در دمای 25 درجه، ثابت تعادل مربوط به یونش یون هیدروژن سولفات ( بی سولفات ) 1.0 * 10 -2 است و از این رو، یک لیتر محلول یک مولار سولفوریک اسید دارای 0.99 مول HSO4- و فقط 0.01 مول یون SO4 است.
خواص شیمیایی محلول آبی سولفوریک اسید با تغییر غلظت اسید به مقدار قابل توجه تغییر می کند. محلول غلیظ اسید به صورت عامل اکسنده عمل می کند و معمولاً به SO2 کاهیده می شود. محلول سولفوریک اسید غلیظ یک عامل خشک کننده بسیار موثر است، به شرط آنکه گاز مرطوب یا مایع مورد نظر با آن ترکیب نشود. سولفوریک اسید می تواند از ترکیب های آلی، عناصر هیدروژن و اکسیژن را به صورت مولکول آب جدا سازد. مثلاً از واکنش قند به فرمول C12H22O11 نسبت هیدروژن و اکسیژن آن مانند آب است، فقط کربن باقی می ماند:
C12H22O11 + 2H2SO4 (غلیظ) => 12C (s) + 11(H2SO4.H2O)
سیاه شدن چوب، پشم، پنبه و پشم و ضایع شدن پوست بدن توسط سولفوریک اسید به واسطه همین نوع واکنش است.
فعالیت اکسید کنندگی سولفوریک اسید غلیظ را می توان توسط اثر آن بر فلزات و نافلزات نشان داد. در این نوع واکنش ها عدد اکسایش اتم گوگرد معمولاً از +6 به +4 کاهید می شود. بسیاری از فلزات از جمله فلزهایی که در سری الکتروشیمایی در زیر هیدروژن قرار دارند توسط محلول داغ و غلیظ سولفوریک اسید اکسید می شوند. مثلاً مس به سولفات مس و قسمتی از اسید به گوگرد دی اکسید کاهیده می شود.
Cu (s) + 2H2SO4 (غلیظ) => CuSO4 (aq) + SO2 (g) + 2H2O
روی که در سری الکتروشیمایی بالای مس قرار دارد، کاهنده قویتری است و سولفوریک اسید غلیظ را به گوگرد یا هیدروژن سولفید می کاهد. کربن توسط سولفوریک اسید گرم و غلیظ به کربن دیوکسید اکسید می شود.
C (s) + 2H2SO4 (غلیظ) => CO2 (g) + 2SO2 (g) + 2H2O
در سولفوریک اسید رقیق بر خلاف غلیظ یون هیدروژن حاصل از یونش اسید، اکسید کننده است نه یون سولفات. مثلاً سولفوریک اسید رقیق بر فلزاتی که بالای هیدروژن قرار گرفته اند، اثر کرده، هیدروژن را آزاد می کند.
Zn(s) + 2H+ (aq) => Zn+2(aq) + H2 (g)
در پایان باید از لحاظ ایمنی اخطار کرد که PH سولفوریک اسید در حدود 1 است. استفاده از این اسید و آزمایش بر روی آن می تواند همراه آزاد شدن گازهای سمی باشد و به هیچ وجه برای دانش آموزان کمتر از دوم دبیرستان توصیه نمی شود.
هیدروژن سه ایزوتوپ دارد که فراوانترین آنها هیدروژن معمولی ( پروتیوم ) با عدد جرمی 1 است و در هسته خود یک پروتون دارد. دو ایزوتوپ دیگر هیدروژن دارای عدد جرمی دو و سه هستند. ایزوتوپی که دارای عدد جرمی دو است، در هسته خود یک پروتون و یک نوترون دارد و آن را دوتریم یا هیدروژن سنگین می نامند و آن را با علامت D نشان می دهند.
هیدروژنی که دارای عدد جرمی 3 است، در هسته خود 1 پروتون و 2 نوترون درد و ترتیم خوانده می شود و آن را با علامت T مشخص می کنند. ترتیم برخلاف پروتیوم و دوتریم که هسته پایدار دارند، پرتوزاست. مقدار ترتیم در طبیعت فوق العاده کم است و آن را معمولاً از واکنش هسته بین لیتیم و نوترون بدست می آورند:
63Li + 10n => 31T + 42He
در یک واکنش معین، نسبت اجزای سازنده محصول بدست آمده توسط هریک از این سه ایزوتوپ یکسان است، زیر آرایش الکترونی هر سه ایزوتوپ به صورت 1s1 می باشد. مثلاً در واکنش کلر ( Cl ) با هیدروژن معمولی، دوتریم و ترتیم به ترتیب TCl , DCl , HCl تشکیل می شود. تنها تفاوت این واکنش ها سرعت آنهاست که برای هیدروژن معمولی از همه بیشتر و برای ترتیم از همه کمتر است. جدول زیر مقایسه هیدروژن سنگین و معمولی و آب تشکیل شده از آن ها را نشان می دهد. توجه شود که هر سه نوع هیدروژن از نظر واکنش شیمیایی یکسان هستند.
| پارامتر |
H2 |
D2 |
پارامتر |
H2O |
D2O |
| دمای ذوب | -259.2 | -254.4 | دمای ذوب | 0.0 | 3.8 |
| دمای جوش | -252.8 | -249.5 | دمای جوش | 100.0 | 101.4 |
| طول پیوند (Å) | 0.742 | 0.742 | چگالی ( 25 C ) | 0.997 | 1.10 |
| گرمای ذوب ( kj/mol) |
0.117 | 0.196 | گرمای ذوب ( kj/mol) |
6.002 | 6.270 |
| گرمای تبخیر ( kj/mol) |
0.903 | 1.225 | گرمای تبخیر ( kj/mol) |
40.6 | 41.6 |
کابرد آب هسته ای در نیروگاه های اتمی جهت خنک کردن راکتور هاست، چون گرمای تبخیر آب هسته بیش از آب معمولی است، می تواند برای این کار بهتر عمل کند. قابل ذکر است آب هسته ای برای بسیاری از گونه ها سمی بوده، اماً مقدار زیادی از آن برای کشتن انسان لازم می باشد.
آهن و خواص شیمیایی آن
آهن یک فلز واسطه بوده که حالت های اکسایش مهم آن +2 و +3 می باشد. از آنجایی که آهن را از سالیان پیش از میلاد نیز می شناختند، کاشف آن مشخص نیست. آهن در اعداد اکسایش مختلف نمک ها و کمپلکس های متنوعی تشکیل می دهد. ترکیب های آهن رنگی اند؛ نمک های آهن ( II ) ( منظور Fe+2 ) سبز روشن و نمک های آهن ( III ) قهوه ای، نارنجی و گاهاً نیز نزدیک به سیاه هستند. آهن خاصیت کاتالیز گری نیز دارد، مثلاً در فرآیند هابر، یا در ساخت چاشنی های TNT ( تری نیترو تولوئن ) به صورت ذرات ریز به کار می رود.
منابع طبیعی آهن
آهن در بعضی از سنگ های آسمانی دیده شده است، اماً به دلیل فعال بودن این فلز، نمی توان آن را به صورت آزاد در کره زمین یافت کرد. کانی های این فلز عبارت اند از: لیمونیت ( Fe2O3.H2O )، پیریت آهن ( FeS2 )، هماتیت ( Fe2O3 ) و مگنتیت ( Fe3O4 ).
آهن و نظرهای اقتصادی مبنی در آن
فلز آهن کاربرد بسیار بالایی در صنعت دارد. به صورت خالص به عنوان تیرآهن در ساختمان سازی، به صورت آلیاژ فولاد در ساخت بدنه ماشین و وسایل صنعتی به کار می رود. نوعی آهن که از پیل الکتروشیمایی روی و آهن ساخته شده، تحت عنوان آهن گالوانیزه یا آهن زنگ نزن در ساخت لوله بخاری، ورقه های شیروانی، لوله های ساختمانی و ... به کار می رود.
شیمی آهن
آهن دارای 10 ایزوتوپ می باشد. آهن در گرما با بیشتر نا فلزها ترکیب می شود و ترکیب های نظیر Fe2O3، FeI2 و ... می دهد. آن دسته از نافلزهایی که عوامل اکسید کننده قوی هستند مانند کلر و اکسیژن، محصولاتی می دهند که در آنها حالت اکسایش آهن +3 می باشد.
آهن ( II ) کربنات ( سیدریت آهن ) FeCO3، در بسیاری از خاکها وجود دارد و چون به آسانی به هیدروژن کربنات محلول تبدیل می شود، می تواند یکی از عوامل سختی آب باشد:
FeCO3 (s) + CO2 (g) + H2O (l) <=> Fe(HCO3)2 (aq)
از بین بردن این سختی آب به راحتی امکان پذیر است:
4Fe(HCO3)2 (aq) + O2 (g) => 2Fe2O3 (s) + 8CO2 (g) + 4H2O(l)
خلصت کوالانسی ترکیب های آهن ( III ) از آهن ( II ) بیشتر است. مثلاً آهن ( III ) کلرید ( FeCl3 ) بی آب خیلی شبیه به آلومنیوم کلرید بی است. یعنی به آسانی تصعید می شود و در الکل و اتر به راحتی حل می گردد و ساختار دی مر Fe2Cl6 دارد.
خوردگی آهن
فلز آهن به راحتی در اثر وجود هوا یا آب به اکسید آهن تبدیل شده و از حالت اصلی خود خارج می گردد. این اکسید به فلز نمی چسبد و به صورت پودر ریخته می شود، لذا آهن کم کم خورده شده و فلز آهن تمام می شود! این مسئله در صنعت نتیجه مطلوبی ندارد و یکی از عیب های آهن محسوب می شود. به همین دلیل لایه کمی از گریس یا رنگ روی آن می پوشانند تا از خطر زنگ زدگی محفوظ به ماند. گالوانیزاسیون نیز یکی از راه های مقابله با این مسئله است.
یکی
از راه های تهیه گاز هیدروژن و کلر و سود سوز آور ( سدیم هیدروکسید )
استفاده از یک سلول الکترولیز به روش کستنر کلنر می باشد. در این روش آند و
کاتد گرافیتی هستند. بین آند و کاتد مطابق شکل زیر ( برای دریافت انیمیشن
به آخر این پست مراجعه کنید. ) نوعی دیواره پلاستیکی قرار داده شده که
یون مثبت سدیم به سمت کاتد حرکت کرده و از این دیواره عبور می کند. اماً
یون OH نمی تواند از این پرده عبور کند، لذا در همان ناحیه باقی می ماند.
محلول آب نمک وارد شده باید فرا سیرشده باشد. در کاتد، گاز هیدروژن آزاد شده و سدیم هیدروکسید محلول در آب در کاتد بدست می آید.
مسئله حائز اهمیت در این پروسه وجود گاز کلر می باشد. اگر قصد آزمایش خانگی دارید، حتماً در محیط باز این کار را انجام دهید. 1000ppm از این گاز کشنده و بوی آن شبیه به لجن می باشد.لازم است دانش آموزان دقت کافی را به عمل آورند تا صدمه ای نبینند.
سود سوز آور یک باز بسیار قوی ( PH 13 ) است، به هیچ وجه با آن شوخی نکنید. در هنگام جا به جا کردن آن از دستکش استفاده نمایید. NaOH ( سود سوز آور یا سدیم هیدروکسید ) در حالت محلول و در حالت خشک خاصیت خورندگی خود را حفظ می کند.
واکنش های رخ داده در این سلول:
2H2O => ↑H2 + 2OH- در کاتد
2NaCl => ↑Cl2 + 2Na+ در آند
جهت دریافت انیمیشن به بخش انیمیشن رفته و به دنبال تهیه کلر و سود سوز آور باشید.
شیمی هیدروژن پروکسید
هیدروژن پروکسید ( H2O2 ) یک ترکیب پیوند کوالانسی می باشد. دمای ذوب آن 0.89 سلسیوس و دمای جوش آن 151 درجه سانتی گراد است. این ماده را در داروخانه ها با نام آب اکسیژنه و در لوازم آرایشی به عنوان ماده بی رنگ کننده مو می شناسند. هیدروژن پروکسید از طریق تشکیل پیوند هیدروژنی به صورت مجتمع در می آید. محلول غلیظ این ماده به سهولت تجزیه شده و این عمل عموماً با انفجار همراه است:
2H2O2 (l) => 2H2O + O2(g) ∆H = -196 Kj
وجود مقادیر کم ناخالصی بعضی یون های فلزی مثل Fe+2، ریز فلز ها ( Pt , Au ) اکسید های فلزی متفاوت ( MnO2 ) و همچنین بزاق، خون تجزیه هیدروژن پروکسید را کاتالیز می کنند.
عدد اکسایش اکسیژن در این ماده -1 است، از این رو هم می تواند به -2 در مولکول آب و هم به صفر به صورت O2 برسد. بنابراین هیدروژن پروکسید هم نقش اکسنده قوی و هم نقش کاهنده ضعیف را دارد و کاهندگی آن تنها در برابر اکسیدکننده های قوی و در محیط اسیدی ظاهر می شود. مثلاً:
As2O3 (s) + 2H2O2 (aq) + H2O => 2H3AsO4(aq) فرآورده ارسینیک اسید است
تهیه هیدروژن پروکسید
تهیه هیدروژن پروکسید در صنعت طی یک فرآیند دو مرحله ای انجام می شود. ابتدا سولفوریک اسید را به پروکسی دی سولفوریک اسید تبدیل می کننده و سپس از واکنش آن با آب، H2O2 بدست می آید:
2H2SO4(aq) => H2S2O8(aq) + H2 (g)
H2S2O8(aq) + 2H2O => 2H2SO4A(aq) + H2O2(aq)
محصول تجارتی هیدروژن پروکسید 30% وزنی H2O2 دارد. محلول 3% آن را در دندان پزشکی به عنوان ضدعفونی به کار می برند. برای جلوگیری از تجزیه این ماده به آن پایدار کننده اضافه می کنند. از هیدروژن پروکسید خالص به عنوان اکسید کننده در موشک نیز بهره برداری می شود.
واکْس به صورت عمومی به مادهای گفته میشود که بر روی جسمی مالیده شود به طور مثال واکس کفش مادهای است که روی کفش برای ایجاد لایهای شفاف و محافظت از نخهای آن مالیده میشود.
انواع مختلفی از واکس برای مصارف مختلف وجود دارد:
واکس چرم برای براق کردن سطوح چرمی، واکس بدنه خودرو برای براق کردن بدنه خودرو، واکس مو برای حالت دادن و براق کردن موی سر و غیره...
معمولاً واکس مادهای کرم مانند است که برای براق کردن سطح مواد مختلف استفاده میشود. امروزه جهت ایجاد رفاه دستگاههایی جهت واکس کفش ایجاد شدهاست که به آن دستگاه براق کننده کفش میگویند که به وسیله یک یا دو برس که به صورت افق قرار دارند رویه و کنارههای کفش را تمیز مینماید.
طرز تهیه واکس کفش:
فرمول شماره یک موم کارنوبا 10 کیلو - موم زرد 3 کیلو- استآرین 1 کیلو - اسید اولئیک 1 کیلو- روغن تربانتین 45 کیلو - مرکب عاج(عاج سیاه) 4 کیلو- رنگ مشکی قابل حل در روغن 5/0 کیلو
موم کارنوبا، موم زرد و استآرین را ذوب کنید. رنگ مشکی را با اسید اولئیک مخلوط و به تدریج تربانتین و عاج سیاه را اضافه نمائید، سپس دو قسمت را مخلوط کنید.
فرمول شماره دو موم زرد 18 کیلو - روغن تربانتین 40 کیلو- صابون 2 کیلو- آب 40 لیتر- رنگ مشکی یا قهوهای قابل حل در روغن به مقدار کافی
ابتدا موم را با حرارت ملایم ذوب و روغن تربانتین را به آن اضافه کنید. سپس محلول داغ آب و صابون را در مقادیر کم به محلول وارد نموده و مرتباً بهم بزنید و در پایان رنگ مورد نظر را بیفزائید.
فرمول شماره سه «واکس بدون رنگ برای نگاهداری چرم»
موم کارنوبا 100 گرم - موم زرد 400 گرم- روغن تربانتین 4 لیتر- کربنات پتاسیم 75 گرم-آب جوش 600 گرم
مومها را ذوب نموده و به محلول جوشان کربنات پتاسیم اضافه کنید، بهم بزنید و از روی آتش برداری، سپس هموزن آن آب جوش اضافه نموده، مرتباً بهم بزنید، آنگاه به تدریج روغن تربانتین را در محلول وارد کنید.
فرمول شماره چهار موم زرد 2 کیلو - تربانتین 4 لیتر- آب 12 لیتر - کربنات پتاسیم 60 گرم- رنگ قهوهای 60 گرم - پودر صابون 2 کیلو
آب، صابون، کربنات پتاسیم و رنگ را توأماً به جوش برسانید و روی موم مذاب بریزید و مجموع را در حرارت 90 درجه سانتیگراد در تربانتین اضافه کنید و خوب بهم بزنید.
دربارهٔ روغن تربانتین:
برای تهیه واکس کفش ابتدا باید حلال مناسب انتخاب شود. سابقاً از حلال نیتروبنزن برای این منظور استفاده میشد اما به علت تأثیر نامطلوبی که بر روی چرم به جا می گذارد استعمال آن بعدها متروک گردید. امروزه از روغن تربانتین به عنوان حلال استفاده میشود، اما در بعضی موارد به علت گرانی این روغن به جای آن پارافین مایع یا نفت به کار میبرند که البته از مرغوبیت واکس خواهد کاست. در انتخاب ماده حلال باید شرایط زیر رعایت شود: 1- درجه جوش آن باید نزدیک به درجه جوش تربانتین باشد. 2- قابلیت تبخیر آن چنانچه زیاد باشد با چند بار باز و بسته شدن سرپوش قوطی واکس، محتوای آن خشک و غیر قابل استفاده میشود و چنانچه قابلیت تبخیر آن کم باشد به هنگام واکس زدن موجب تأخیر عمل شده و از براق شدن چرم جلوگیری میکند. بنابراین قابلیت تبخیر این ماده باید متناسب با زمان لازم باشد به طوری که عیبهای فوق ظاهر نشود. 3- قابلیت حل آن برای سایر مواد لازم در ساخت واکس و حفظ این مواد در درجات حرارت مختلف 4- علاوه بر مواد فوق باید روغن مناسبی در واکسها به کار رود که جایگزین چربی طبیعی چرم باشد و در حفظ آن عمل نماید. برای این منظور معمولاً از استآرین، اولئین، لانولین و پارهای روغنهای نباتی به مقدار مناسب استفاده میکنند.
پدیده تبادل یون برای اولین بار در سال 1850 و به دنبال مشاهده توانایی خاکهای زراعی در تعویض برخی از یونها مثل
با یون کلسیم و منیزم موجود در ساختمان آنها گزارش شد. در سال 1870 با انجام آزمایشهای متعددی ثابت شد که بعضی از کانیهای طبیعی بخصوص زئولیتها واجد توانایی انجام تبادل یون هستند. در واقع به رزینهای معدنی ، زئولیت میگویند و این مواد یونهای سختی آور آب (کلسیم و منیزیم) را حذف میکردند و به جای آن یون سدیم آزاد میکردند از اینرو به زئولیتهای سدیمی مشهور شدند که استفاده از آن در
مزایای زیاد داشت چون احتیاج به مواد شیمیایی نبود و اثرات جانبی هم نداشتند.
اما زئولیتهای سدیمی دارای محدودیتهایی بودند. این زئولیتها میتوانستند فقط سدیم را جایگزین کلسیم و منیزیم محلول در آب نمایند و آنیونهایی از قبیل سولفات ، کلراید و سیلیکاتها بدون تغییر باقی میمانند. واضح است چنین آبی برای صنایع مطلوب نیست. پس از انجام تحقیقات در اواسط دهه 1930 در هلند زئولیتهایی ساخته شد که به جای سدیم فعال ، هیدروژن فعال داشتند. این زئولیتها که به تعویض کنندههای کاتیونی هیدروژنی معروف جدید ، سیلیس نداشته و علاوه بر این قادرند همزامان هم سختی آب را حذف کنند و هم قلیائیست آب را کاهش دهند.
برای بهبود تکنولوژی تصفیه آب ، گامهای اساسی در سال 1944 برداشته شد که باعث تولید زرینهای تعویض آنیونی شد. زرینهای کاتیونی هیدروژنی تمام کاتیونی آب را حذف میکنند و رزینهای آنیونی تمام آنیونهای آب را از جمله
را حذف مینمایند ، در نتیجه میتوان با استفاده از هر دو نوع زرین ، آب بدون یون تولید کرد. همچنین پژوهشگران دریافتند که سیلیکات آلومینیم موجود در خاک قادر به تعویض یونی میباشد. این نتیجه گیری با تهیه ژل سیلیکات آلومینیم از ترکیب محلول سولفات آلومینیم و سیلیکات سدیم به اثبات رسید. بنابراین اولین رزین مصنوعی که ساخته شد سیلیکات آلومینیم بود. و امروزه اکثر زرینهای تعویض یونی که در تصفیه آب بکار میروند رزینهای سنتزی هستند که با پلیمریزاسیون ترکیبات آلی حاصل شدهاند.
رزینهای موازنه کننده یون ، ذرات جامدی هستند که میتوانند یونهای نامطلوب در محلول را با همان مقدار اکی والان از یون مطلوب با بار الکتریکی مشابه جایگزین کنند. رزینهای تعویض یونی شامل بار مثبت کاتیونی و بار منفی آنیونی میباشد بگونهای که از نظر الکتریکی خنثی هستند. موازنه کنندهها با محلولهای الکترولیت این تفاوت را دارند که فقط یکی از دو یون ، متحرک و قابل تعویض است به عنوان مثال ، یک تعویض کننده کاتیونی سولفونیک دارای نقاط آنیونی غیر متحرکی است که شامل رادیکالهای آنیونی SO
2-3
میباشد که کاتیون متحرکی مثل
+
H یا
+
Na به آن هستند.
این کاتیونهای متحرک میتوانند در یک واکنش تعویض یونی شرکت کنند به همین صورت یک تعویض کننده آنیونی دارای نقاط کاتیونی غیر متحرکی است که آنیونهای متحرکی مثل
-
Cl یا
-
OH به آن متصل میباشد. در اثر تعویض یون ، کاتیونها یا آنیونهای موجود در محلول با کاتیونها و آنیونهای موجود در رزین تعویض میشود ، بگونهای که هم محلول و هم رزین از نظر الکتریکی خنثی باقی میماند. در اینجا با تعادل جامد مایع سروکار داریم بدون آنکه جامد در محلول حل شود. برای آنکه یک تعویض کننده یونی جامد مفید باشد باید دارای شرایط زیر باشد:
در مورد رزینهای کاتیونی هر دانه رزین با آنیون غیر تحرک و یون متحرک
+
H را میتوان همچون یک قطره اسید سولفوریک با غلظت 25% فرض نمود. این قطره در غشایی قرار دارد که فقط کاتیون میتواند از ان عبور نماید. شکل زیر تصویر یک دانه رزین و تصویر معادل یک قطره اسید سولفوریک 25% نشان میدهد.
رزینها بر حسب گروه عامل تعویض متصل به پایه پلیمری رزین به چهار دسته تقسیم میشوند:
بطور کلی رزینهای نوع قوی در یک محدوده وسیع PH و رزینهای نوع ضعیف در یک محدوده کوچک از PH مناسب هستند. ولیکن با استفاده از رزینهای نوع ضعیف ، صرفه جویی قابل توجهی در مصرف مواد شیمیایی مورد نیاز برای احیا رزین را باعث میشود. رزینهای کاتیونی قوی قادر به جذب کلیه کاتیونهای موجود در آب میباشد ولی نوع ضعیف قادر به جذب کاتیونهای هستند که به قلیائست آب مرتبط است و محصول سیستم
است.
نوع قوی
نوع ضعیف
مزیت رزینهای کاتیونی ضعیف بازدهی بالای آنها در مقایسه با رزینهای کاتیونی قوی میباشد ، در نتیجه باعث تولید پساب کمتر در احیا مکرر میگردد. اصولا زمانی که هدف جداسازی کلیه کاتیونهای آب است بکارگیری توام رزین کاتیونی قوی و ضعیف اقتصادی تر از بکارگیری رزینهای کاتیونی قوی میباشد. رزینهای آنیونی قوی قادر به جذب کلیه آنیونهای موجود در آب بوده ولی رزینهای آنیونی قادر به جذب آنیون اسیدهای قوی نظیر اسید سولفوریک ،
و
میباشد. رزینهای آنیونی ضعیف مقاومتر از رزینهای آنیونی قوی بوده و به همین جهت در سیستمهای تصفیه آب ، رزینهای آنیونی قوی در پاین دست رزینهای آنیونی ضعیف قرار میگیرند.
کامپوزیتها یا چندسازههای مصنوعی
از اولین کامپوزیتها یا همان چندسازههای ساخت بشر میتوان به کاه گل
اشاره کرد. قایقهایی که سرخپوستها با قیر و بامبو میساختند و
تنورهایی که از گل ، پودر شیشه و پشم بز ساخته میشدند و در نواحی مختلف
کشورمان یافت شده است، از کامپوزیتهای نخستین هستند. بسیاری از نیازهای
صنعتی صنایعی مانند صنایع فضایی ، راکتورسازی ، الکترونیکی
و غیره نمیتواند با استفاده از مواد معمولی شناخته شده ، برآورده شود.
اما قسمتی از آن نیازها ، میتواند با استفاده از چندسازهها یا
کامپوزیتها برآورده گردد. چندسازهها به موادی گفته میشود که از مخلوطی
از دو یا چند عنصر ساخته شده باشند.
در حالیکه در چندسازهها ، نه فقط خواص هر یک از اجزاء آن برجا باقی
میماند، بلکه در نتیجه پیوستن آنها با یکدیگر ، خواص جدیدتر و بهتر هم
بدست میآید. مواد مختلط همیشه ناهمگن میباشد. بررسیها و تحقیقات برای
دست یافتن به مواد جدیدتر با خواص مکانیکی بهتر ، همواره انجام میگرفته و
هنوز هم همگام با پیشرفت صنایع دنبال میگردد. در این بررسیها ، اغلب این
هدف دنبال میشود که به موادی با نسبت مناسب از استحکام کششی به چگالی ،
استحکام حرارتی بالا و خواص ویژه سطح خارجی دست یابند.
انواع چندسازهها را میتوان به گروههای زیر طبقهبندی نمود.
ساختمان و اندازه این الیاف شیشهها بسیار متغیر است. کوچکترین آنها
بوسیله چشم غیر مسلح دیده نمیشود و بسیار ریز هستند. اندازههای کمی
بزرگتر از آن ذراتی هستند که در کارخانجات ساخت فرآوردههای الیاف شیشهها
به کمک هوا نقل و انتقال یافته و سبب شوزش پوست و بینی و گلو میشود.
الیاف شیشه متداولترین الیاف مصرفی کامپوزیتها در دنیا و ایران است که
متاسفانه در ایران ساخته نمیشود. انواع الیاف شیشه عبارتند از انواع E ، C
، S و کوارتز. ترکیب الیاف شیشه نوع E یا الکتریکی ، از جنس آلومینوبور و سیلیکات کلسیم بوده و دارای مقاومت ویژه الکتریکی بالایی است.
الیاف شیشه نوع S ، تقریباْْ 40 درصد استحکام بیشتری نسبت به الیاف شیشه
نوع E دارند. الیاف شیشه نوع C یا الیاف شیشه شیمیایی ، دارای ترکیب بور و سیلیکات کربنات دو سود
بوده و نسبت به دو مورد قبل پایداری شیمیایی بیشتری بخصوص در محیطهای
اسیدی دارد. الیاف شیشه کوارتز ، بیشتر در مواردی که خاصیت دیالکتریک
پایین نیاز باشد، مانند پوشش آنتنها و یا رادارهای هواپیما استفاده
میشوند.
سبکی ، سهولت شکلدهی ، مقاومت در برابر خوردگی و قابلیت آببندی ، از
ویژگیهای کامپوزیتهایی است که در صنعت ساختمان بکار میرود. فایبرگلاس یا
الیاف شیشه که پرکاربردترین کامپوزیتها هستند، فیبرها یا الیاف ساخت بشر
است که در آن ، ماده تشکیل دهنده فیبر ، شیشه
است. الیاف شیشهها ، موارد استفادههای فراوانی از جمله در ساخت بدنه
خودروها و قایقهای تندرو و مسابقهای ، کلاه ایمنی موتورسواران ، عایقکاری
ساختمانها و کورهها و یخچالها و … دارند.
سابقه استفاده از کامپوزیتهای پیشرفته به دهه 1940 باز میگردد. در
آن زمان ارتشهای آمریکا و شوروی سابق در رقابتی تنگاتنگ با یکدیگر ، موفق
به ساخت کامپوزیت پایه پلیمری الیاف بور - رزین اپوکسی برای استفاده در صنعت هوا فضا
شدند. 20 تا 30 سال پس از آن ، کامپوزیتهای پایه پلیمری بطور گستردهای
به سوی صنایع شهری از جمله ساختمان و حمل و نقل روی آوردند. بطور مثال
امروزه خودروهایی ساخته میشود که تماماْْ کامپوزیتی هستند. استفاده از
کامپوزیتها در این کاربرد به علت ویژگیهایی چون وزن کمتر ، در نتیجه سوخت
کمتر و عمر طولانیتر آنهاست.
با توجه به پایداری بسیار زیاد کامپوزیتهای پایه پلیمری و مقاومت بسیار
خوب آنها در محیطهای خورنده، این کامپوزیتها، کاربردهای وسیعی در صنایع
دریایی پیدا کردهاند که از آن جمله میتوان به ساخت بدنه قایقها و کشتیها
و تاسیسات فراساحلی اشاره داشت. استفاده از کامپوزیتها در این صنعت،
حدود 60% صرفهجویی اقتصادی داشته است که علت اصلی آن مربوط به پایداری
این مواد است. صنعت ساختمان پرمصرفترین صنعت برای مواد کامپوزیتی است.
استخرهای شنا ، وان حمام ، سینک ظرفشویی و دستشویی ، کفپوش ، نماپوش ،
سقفپوش ، برجهای خنککننده و … همگی کامپوزیتهای پایه پلیمری هستند.
میزان نیترات در آب شهری و سایر منابع آب عمومی باید بوسیله پایش و آزمایش منظم در حد استاندارد نگاه داشته شود. اما اگر منبع آب مورد استفاده شما تحت نظارت نیست، باید میزان نیترات آن اندازه گیری شود و در صورت بالا بودن میزان نیترات، آب تصفیه شود
اگر چاه خصوصی دارید، باید آب چاه از لحاظ میزان نیترات به شکلی منظم (هر یک یا دو سال یک بار) از جمله از لحاظ میزان نیترات مورد آزمایش قرار گیرد.
توجه داشته باشید جوشاندن آب نه تنها میزان نیترات آن را کاهش نمیدهد، بلکه غلظت نیترات را افزایش میدهد.
برخی از انواع دستگاه های خانگی تصفیه آب، نیترات آب را هم کاهش می دهند؛ البته این دستگاهها باید به طور مرتب سرویس و نگهداری شوند.
روشهای تصفیه آب از نیترات
روش های مختلفی که برای تصفیه آبهای زیرزمینی به کار میروند، ممکن است مشکل، گران قیمت باشند و تاثیر کاملی هم نداشته باشند. بنابراین پیشگیری از آلودگی آب بهترین راه محسوب می شود.
روشهایی که برای تصفیه آب می توتان به کار برد، شامل تقطیر، اسمز معکوس، تعویض یون و اختلاط است.
تقطیر: در این روش آب جوشانده میشود، و بخار حاصل روی یک سطح سرد (کندانسور) فشرده می شود، نیترات وسایر مواد معدنی در آب در حال جوشیدن باقی می ماند.
اسمز معکوس: در این روش آب با فشار از میان غشایی گذرانده میشوند که نیترات و سایر مواد معدنی را فیلتر می کند. نیم تا دو سوم آب پشت این غشا باقیمی ماند که به عنوان آب پسمانده دور ریخته میشود. سیستمهای اسمز معکوس با کارآیی بالا از فشارهای در حد یک میلیون پاسکال استفاه میکنند.
تعویض یون: در این روش از ماده دیگری مانند کلراید استفاده میشود، که جای خود را با نیترات عوض میکند. یک واحد تعویض یونی با گلولههای رزینی خاصی پر شده است، که با کلراید شارژ شدهاند. آب از میان این گلولهها میگذرد، و رزین نیترات آب را با کلراید تعویض میکند. هر چه آب بیشتری از روی رزین عبور میکند، نیترات بیشتری از آب گرفته میشود و کلراید به آن پس داده میشود. رزینی که نیترات را جذب کرده و کلراید را پس داده داد است، با شستن با محلول کلرید سدیم (نمکی) دوباره شارژ می کنند. محلول باقیمانده از این روند تصفیه که حاوی مقدار زیادی نیترات است را باید به طور مناسبی دفع کرد.
اختلاط یا مخلوط کردن: در این روش یک راه دیگر برای کاهش میزان نیترات آب آشامیدنی است. آب آلوده با میزان نیترات بالا با آبی از منبع دیگر مخلوط میشود تا غلظت کلی نیترات کاهش یابد. آب حاصل هنوز برای نوزادان بیخطر نیست، اما برای بزرگسالان سالم و دام ها قابلپذیرش است.
فیلترهای زغالی (شارکول) و سبککنندههای آب به قدر کافی نیترات آب را کاهش نمیدهند. جوشاندن آب نه تنها آب آلوده به نیترات را تصفیه نمیکند، بلکه میزان غلظت نیترات آب را میافزاید. در برخی نقاط حفر چاه عمیقتر ممکن است آب با میزان نیترات کمتر فراهم کند.
اما در بسیاری مواد موثرترین گزینه استفااده از آب بطری برای نوشیدن و آشپزی است.
استراتژی مدیریت در ادامه مطلب
نانو پودر ها
نانوپودر چيست؟
پودرها ذرات ريزي هستند
كه از خُرد كردن قطعات جامد و بزرگ، يا تهنشين شدن ذرات جامدِ معلق در
محلولها به دست ميآيند. بنابراين، نانوپودرها را ميتوان مجموعهي از ذرات
دانست كه اندازهي آنها كمتر از 100 نانومتر است. (اگر يك متر را يك
ميليارد قسمت كنيم، به يك نانومتر ميرسيم. طبق تعريف، ساختار نانومتري
ساختاري است كه اندازهي آن كمتر از 100 نانومتر باشد.(
چه پودري را ميتوان نانوپودر به شمار آورد؟
پودرها در سه حالت نانوپودر به شمار ميآيند:
حالت اول: ساختار ذرات تشكيلدهندهي پودر، در حد نانومتر باشد.
يعني اگر ساختار ذرات
تشكيلدهندهي يك پودر را به صورت يكي از اشكال منظم هندسي در نظر بگيريم،
ميانگين اندازهي اضلاع آن بين 1 تا 100 نانومتر باشد. مهمترين اشكال
هندسي، كُره و مكعباند. اگر ساختار ذرات تشكيلدهندهي پودر را كُره فرض
كنيم، بايد قطر كُره كمتر از 100 نانومتر باشد و چنانچه ساختار آنها مكعب
فرض شود، ميانگين اضلاع مكعب بايد در محدودهي 1 تا 100 نانومتر قرار گيرد.
به عبارت حسابيتر، ميانگين اضلاع مكعب بايد در اين رابطه صدق كند:
1 نانومتر < (a+b+c)/3 < 100 نانومتر
براي مثال، بلورهاي نمك طعام ساختاري مكعبشكل دارند. (شكل شمارهي 1(
يادآوري: اگر بيشترِ ذرات تشكيلدهندة پودر، ابعادي ميان 1 تا 100 نانومتر داشته باشند، آن پودر، نانوپودر محسوب ميشود.
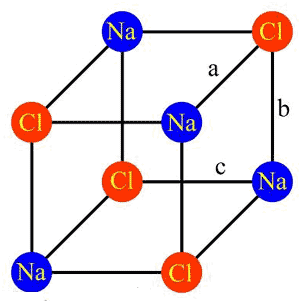
شكل 1: ساختار بلور نمك طعام، مكعبي است.
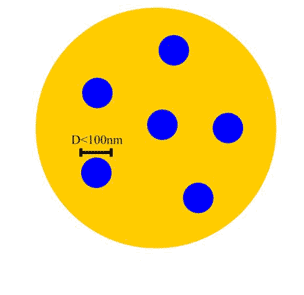
حالت دوم: دانههاي تشكيلدهندة پودر، ابعاد نانومتري داشته باشند.
در حالتي كه اندازهي ذرات
تشكيلدهندهي پودر از صد نانومتر بيشتر باشد، كافي است دانههاي آن ابعاد
نانومتري داشته باشند تا نانوپودر به شمار آيند. يك مثال براي فهم اين
موضوع، اتمهايي هستند كه به صورت منظم و درون سلولهايي كه آنها را "دانه"
ميناميم، كنار هم قرار گرفتهاند. مواد بلوري جامد نيز از سلولهاي ريزي
تشكيل شدهاند كه به آنها دانه ميگويند. درون هر دانه، اتمها در يك جهت
خاص و رديفهاي موازي چيده شدهاند و تفاوت دو دانة مجاورِ هم، تفاوت در
همين جهتگيري اتمهاست.
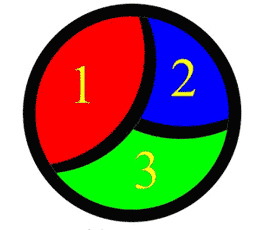
شكل 2: اين ذره، حاوي سه دانه است.
شكل 3: اتمها با زاويهي 45 درجه نسبت به افق چيده شدهاند.
شكل 4: اتمها با زاويهي 90 درجه نسبت به افق چيده شدهاند.
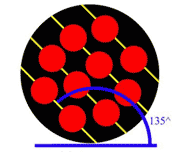
شكل 5: اتمها با زاويه ي 120 درجه نسبت به افق چيده شدهاند.
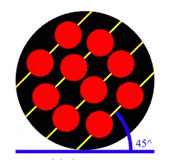
در دانهي 1 (شكل 3)، اتمها در رديفهاي موازي و با زاويهي 45 درجه نسبت به افق چيده شدهاند. در دانهي 2 (شكل 4) اتمها
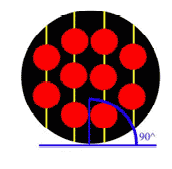
با زاويهي 90 درجه و در دانهي 3 (شكل 5) اتمها با زاويهي 120 درجه
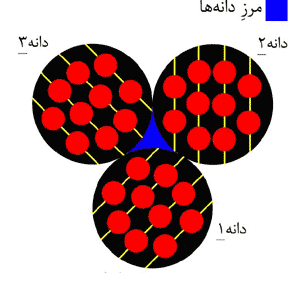
نسبت به افق چيده شدهاند. وقتي اين سه دانه در كنار يكديگر قرار بگيرند،
يك ذره تشكيل ميشود. (شكل 6) به فضاي خالي بين دانهها «مرز دانه»
ميگويند. مرز دانه محلي است كه جهت چيده شدن اتمها عوض ميشود.
همچنين دانهها را ميتوان مانند آجرهاي يك ديوار فرض كرد. در اين صورت، مرز بين دانهها ملات بين آجرهاست. اگر قطر اين دانهها بين 1 تا 100 نانومتر باشد، ذرات حاصل تشكيل نانوپودر ميدهند.
هر چه قطر دانههاي يك ذره
كمتر باشد (البته با حجم ثابت)، تعداد دانههاي تشكيلدهندهي آن بيشتر
خواهد بود (واضح است كه هر چه آجرهاي تشكيلدهندهي يك ديوار 1 متر در 1
متر كوچكتر باشند، تعداد آجرها بيشتر خواهد بود) و هر چه تعداد دانهها
بيشتر شود، مانند گرههاي يك فرش، تار و پود آن محكمتر و درهمتنيدهتر است
و بنابرين استحكام محصول بيشتر خواهد بود.
شكل 6: سه دانه در مجاورت هم قرار گرفتهاند تا يك ذره را تشكيل دهند.
يادآوري: اگر درصد قابل توجهي از دانههاي تشكيلدهندهي ذرات، نانومتري باشند، پودر، نانوپودر محسوب ميشود.
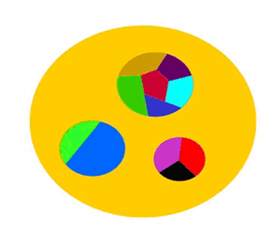
حالت سوم: ذرات نانوپودر و ذرات پودر معمولي تركيب شوند.
در اين حالت، پودر را «نانوپودر كامپوزيتي» مينامند. كامپوزيت كه از كلمهي انگليسي composition گرفته شده، به معني تركيب دو يا چند
چيز است. ملموسترين مثال براي كامپوزيت، كاهگل است. در كاهگل رشتههاي
كاه در زمينهي گِل پراكنده شدهاند. در نانوپودرهاي كامپوزيتي نيز ذرات
نانومتري در زمينهي ذرات بزرگتر (غير نانومتري)پراكنده شدهاند (شكل7).
شكل 7: ذرات با قطر نانومتري در زمينه پراكنده شدهاند.
علت تركيب شدن آنها اختلاف
خواص اين دو ماده است. در كامپوزيت معمولاً زمينه از يك مادهي نرم و
افزودني از مادهي سخت انتخاب ميشود. در اين صورت، هنگامي كه به ماده
نيرو وارد ميشود، زمينه نيرو را به رشته يا پودر اضافهشده منتقل ميكند
تا بتواند در برابر نيروي واردشده مقاومت بيشتري داشته باشد. (شكل شمارهي
8(
شكل 8 : در يك نانوكامپوزيت، ذرات نانويي در زمينهاي غيرنانويي پراكنده شدهاند